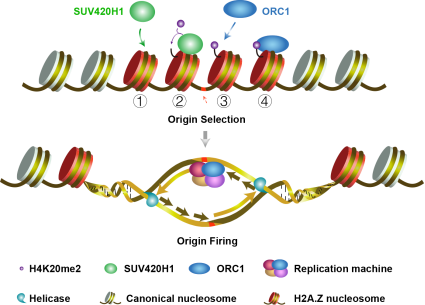
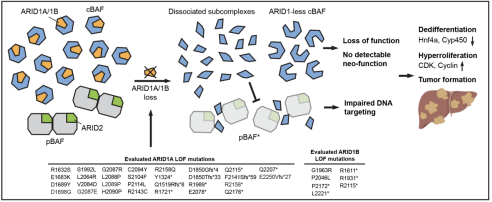
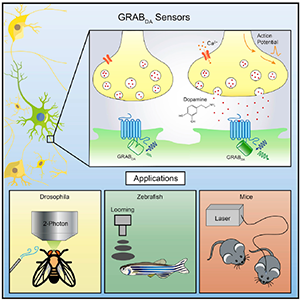
-
王竞 Jing WANG

王竞 Jing WANG
分子生理学研究所资深研究员、所长
wangjing@szbl.ac.cn
Timeline
2025 至今 深圳湾实验室 分子生理学研究所 资深研究员、所长
2004-2024 加州大学圣地亚哥分校 神经生物学系 终身教授、系主任
2000-2004 哥伦比亚大学 博士后
1997-2000 贝尔实验室 博士后
1991-1997 爱荷华大学 博士
1982-1990 清华大学 学士、硕士
研究领域
王竞博士的研究专注于神经回路如何处理感官信息,聚焦于进化塑造的先天行为的神经调控机制。利用果蝇作为模型,借助其强大的遗传工具和简化的神经解剖结构,他的研究以工程学原理为框架,探索神经回路的感官信息处理方式和行为调控逻辑。研究成果
反馈机制是控制理论的重要概念,在神经系统中广泛存在。正反馈提升灵敏度,而负反馈则增强稳定性、抑制过度反应。王竞博士的研究揭示了神经调节剂(如神经肽和激素)如何通过重塑神经回路使动物行为适应环境变化、代谢需求和生理状态。他的研究显示,饥饿状态通过正反馈增强吸引信号、负反馈抑制排斥信号,从而改变果蝇的嗅觉处理。此外,年龄与种群密度通过激素调控两性互动行为,这些研究对神经科学及相关领域提供了深远启示。
王竞博士还在技术层面推动了神经科学的新突破。他率先将钙离子探针GCaMP用于体内细胞成像,开创了神经回路与行为研究的新纪元。他开发的基于NFAT的活性报告系统,被广泛用于标记和操控与行为相关的神经回路。此外,通过引入三光子显微镜技术并结合荧光蛋白与GCaMP,他首次实现了果蝇活体脑的非侵入式成像。
近五年,王竞的研究重点转向肠脑轴的功能研究。他发现,肠道释放的神经肽不仅调控食欲,还能协调大脑中不同的回路模块。这些发现表明,肠道神经肽驱动果蝇在饥饿和饱食状态下对觅食和求偶行为进行优先级选择。这一研究为神经回路灵活性及操作逻辑的理解提供了全新视角。
王竞博士多次担任NIH和NSF等机构的同行评审专家,曾荣获塞尔学者奖和贝克曼青年研究员奖,在Nature、Cell等国际知名期刊发表了50多篇论文,他的研究受到了同行的高度评价和新闻媒体报道。荣誉
贝克曼青年研究院奖
塞尔学者奖
代表论文
1.Lin HH, Kuang MC, Hossain I, Xuan Y, Beebe L, Shepherd AK, Rolandi M,Wang JW.(2022) A nutrient-specific gut hormone arbitrates between courtship and feeding.Nature. 602(7898):632-638.
2. Sethi S, Lin HH, Shepherd AK, Volkan PC, Su CY,Wang JW.(2019) Social Context Enhances Hormonal Modulation of Pheromone Detection in Drosophila.Current Biology. 29(22):3887-3898.
3. Tao X, Lin HH, Lam T, Rodriguez R,Wang JW, Kubby J. (2017) Transcutical imaging with cellular and subcellular resolution.Biomedical Optics Express. 8(3):1277.
4. Lin HH, Cao DS, Sethi S, Zeng Z, Chin JS, Chakraborty TS, Shepherd AK, Nguyen CA, Yew JY, Su CY,Wang JW.(2016) Hormonal Modulation of Pheromone Detection Enhances Male Courtship Success.Neuron. 90(6):1272-85.
5. Ko, K.I., Root, C.M., Lindsay, S.A., Zaninovich, O.A., Shepherd, A.W., Wasserman, S.A., Kim, S.M.,Wang, J.W.(2015) Starvation Promotes Concerted Modulation of Appetitive Olfactory Behavior via Parallel Neuromodulatory Circuits.eLife. 4:e08298.
6.Masuyama K, Zhang Y, Rao Y,Wang JW.(2012) Mapping neural circuits with activity-dependent nuclear import of a transcription factor.J. Neurogenetics.26: 89-102.
7. Root C.M., Ko K.I., Jafari A., andWang J.W.(2011) Presynaptic facilitation by neuropeptide signaling mediates odor-driven food search.Cell.145: 133-44.
8. Semmelhack J.L. andWang J.W.(2009) Select Drosophila glomeruli mediate innate olfactory attraction and aversion.Nature.459:218-23.
9. Root C.M., Masuyama K., Green D.S., Enell L.E., Nässel D.R., Lee C.H.,Wang J.W.(2008) A presynaptic gain control mechanism fine-tunes olfactory behavior.Neuron.59:311-21.
10.Wang, J.W., Wong, A.M., Flores, J., Vosshall, L.B., and Axel, R. (2003). Two-photon calcium imaging reveals an odor-evoked map of activity in the fly brain.Cell.112: 271-282.