周雷课题组揭示结合面水分子在新冠刺突蛋白抗体结合中的关键作用
近日,深圳湾实验室分子生理所周雷课题组在期刊Journal of Biomolecular Structure and Dynamics发表了题为”Interfacial water molecules contribute to antibody binding to the receptor-binding domain of SARS-CoV-2 spike protein”的研究论文。此工作探究了新冠刺突 (Spike) 蛋白的RBD区域和特异抗体的结合自由能,尤其关注在蛋白-蛋白结合界面上的水分子的处理方式并研究其重要功能。传统自由能计算方法如MM/PBSA主要依赖隐式(implicit)溶剂模型;通过显式(explicit)方式处理结合界面上的水分子,此工作提高了自由能计算的准确度,揭示了结合面水分子在抗原抗体结合中起的关键作用,以及Omicron变体呈现的严重免疫逃逸的一种潜在机制。这项工作为针对新冠病毒的抗体筛选提供了更为优秀的理论计算方法,并进一步加深了对“水”这一貌似简单但是至今尚未充分理解的分子的理解。
水是生命的源泉,是地球上最基本的物质之一,在生命演化中扮演着重要角色。水分子包含氢、氧两种元素(分子式:H2O),看似简单但其内在机制至今尚未完全理解。配体与目标蛋白的结合或蛋白质复合物的形成始于脱湿(dewetting)过程。结合界面上的水分子(简称界面水分子)很可能是在脱湿过程中留下的,因为其与表面氨基酸侧链存在与一般溶剂水分子相比更稳定的相互作用。界面水分子在蛋白-蛋白复合物形成和稳定中起着重要作用,理论计算揭示其对结合自由能的贡献可以高达四分之一。事实上,水分子可以作为一种特殊类型的粘合剂,在结合界面上填充特定的空间来促进蛋白-蛋白结合。不断积累的实验证据,特别是高分辨率X射线晶体结构,证实了结构水分子和界面水分子的普遍分布。与蛋白质表面水化层中的水分子类似,蛋白内部的结构水分子和界面水分子具有与普通溶剂水分子(bulk water)完全不同的结构和动态特性,实际上是常温下存在的“冰”分子,对蛋白的结构、动态和功能有着重要影响。
针对水的溶剂化效应,理论计算实现了从隐式溶剂模型(implicit solvent model, 如PB和GB模型)到显示溶剂模型(explicit solvent model)的跨越。近几十年在硬件和软件方面的算力提高,极大的推动了显式水模型,如SPC,TIP3P,TIP4P,在理论计算尤其是分子动力学(MD)模拟中的应用。相比隐式溶剂模型,显式溶剂模型对水分子中的原子和生物大分子中的每个原子都进行相同级别的显示处理,故而精准复现了溶剂的强相互作用(氢键)和特殊相互作用(水桥)以及体系中复杂介电常数的描述。
在过去的三年中,新型冠状病毒(SARS-CoV-2)给人类带来了严重的灾害。抗体是预防和治疗SARS-CoV-2的有效手段。数以千计的针对SARS-CoV-2的抗体的鉴别,尤其是重要抗体和Spike蛋白间的结构信息,为理论计算打下了坚实的基础。作者在Spike蛋白RBD区域和抗体复合物的结合自由能计算研究中加入显式处理的界面水分子,探究界面水分子对结合的影响。具体步骤包括应用开发的算法在MD模拟轨迹中实时捕捉界面水分子,然后将这些水分子进行显式处理并包含在随后的 MM/PBSA计算中。整个过程概括为图1所示。
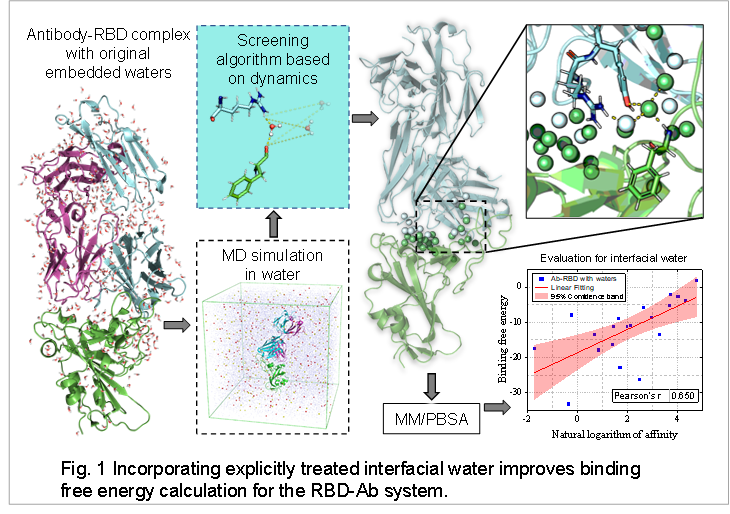
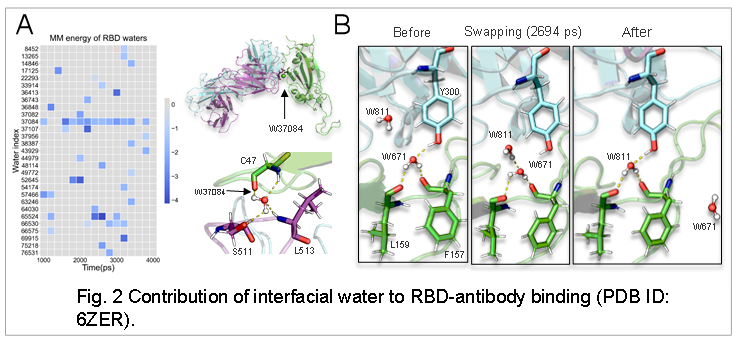
结果显示,这个方法极大地提高了结合自由能计算的结果,并且通过对界面水的分析,发现了界面水对RBD和抗体结合的重要作用。如图2A所示,分解模拟过程中RBD-Ab结合面上单个水分子对MM项的能量贡献显示,大多数结合面上的水分子对结合自由能都有着瞬时贡献,但界面水分子做出了持续的贡献。界面水分子在模拟过程中和周围的RBD氨基酸侧链以及抗体氨基酸侧链形成一个稳固的氢键网络,这是其促进结合的重要证据(图2B)。
使用相同的MM/PBSA程序,作者还评估了SARS-CoV-2变体(包括Alpha、Beta、Delta、Gamma和Omicron)的RBD与抗体之间的结合自由能。我们发现结合Omicron的抗体Beta 55采用了一种不同于野生型(WT)SARS-CoV-2和其他变体的独特的结合模式。在WT RBD的Q493号位置,界面水分子对结合自由能做出了持续且显著的贡献,而相同的位置Omicron由谷氨酰胺(Gln)突变成了精氨酸(Arg),直接导致消除了Q493侧链和界面水分子以及抗体侧链之间形成氢键的可能,进而导致了抗体和Omicron RBD之间的连接减弱(图3A)。这可能是靶向Omicron RBD的抗体转向另一种不同结合模式的潜在原因(图3B)。在Alpha菌株的N501Y突变中也可以观察到类似的情况。
