睡眠是大家司空见惯的现象。其普遍性不言而喻,但睡眠有两大问题:睡眠的机理(HOW)和为什么要睡眠(WHY),都没有明确的答案。
How是每一个个体睡眠的机制,Why是进化中为什么出现睡眠,睡眠的作用是什么,也含睡眠的意义。
睡眠的分子和细胞机理,迄今尚不清楚,近十年全世界有较多研究。
从2017年起,饶毅实验室发表了五篇论文,涉及睡眠的分子机理。2022年5月,美国遗传学会主办的、摩尔根创办的《遗传学》杂志线上发表饶毅实验室第六篇睡眠分子机理的文章。
对睡眠机理的研究,科学界早先注重参与睡眠的脑区,后来到现在都有很多电生理研究睡眠的细胞机理。
而对于睡眠的分子机理,早期依赖对神经递质的研究,例如组织胺等。二十年前开始有果蝇遗传学研究睡眠的分子机理。果蝇的遗传学和分子生物学强大,有助于揭示睡眠的分子机理。但果蝇的睡眠与哺乳类的睡眠现象是否保守、机理上是否保守,并不清楚:有些证据支持,有些反对。在果蝇发现影响睡眠的分子比较多,但有些分子在果蝇和哺乳动物都参与调控睡眠,但有些分子只在果蝇参与睡眠、而在哺乳动物并不调控睡眠。
饶毅实验室的研究生钱永军等于2017年发表文章(1),证明果蝇的神经递质五羟色胺(5-HT)的受体2b,在两个神经元中起调控整个果蝇睡眠的作用,包括睡眠剥夺后的回复过程(睡眠的自稳态)。
在老鼠,五羟色胺是否参与睡眠调控,有很长时间的争议,有人说有,有人说无。饶毅实验室的博士后张娴等于2018年发表的文章(2),证明五羟色胺确实参与老鼠睡眠调控,但影响的程度不如在果蝇那么大。
2019年,饶毅实验室博士后邓博文等的化学连接组工作(3),也研究了更多参与果蝇睡眠调控的神经递质及其受体。
2019年,饶毅实验室的研究生戴熙慧敏和周恩兴等发现(4),长期被人们认为在生物体内不存在的D型丝氨酸,不仅存在于果蝇,而且调控果蝇的睡眠。戴熙慧敏和周恩兴等发现,D型丝氨酸可以在肠道上皮细胞(不是肠道内部细菌)合成,而作用于神经细胞的NMDA受体再调控睡眠。这一作用在果蝇很显著,但迄今没有看到证据D型丝氨酸是否在哺乳动物调控睡眠,也没有在哺乳动物的肠道上皮细胞发现D型丝氨酸。
2021年,戴熙慧敏和周恩兴等发现(5)果蝇的神经递质乙酰胆碱(ACh),通过作用于果蝇有些细胞的一种ACh受体亚型nAChRα3而刺激多巴胺能神经元起促进觉醒的作用,而通过另外一种ACh受体nAChRα2刺激鱆胺能神经元而促进睡眠。但是,这些研究也没有类似的哺乳类研究。
饶毅实验室最新的睡眠研究(6),在果蝇和老鼠研究了同一个分子对睡眠的作用,发现这个分子在果蝇和老鼠都调控睡眠。
这篇文章的作者为:研究生刘子怡、博士后姜丽芬和李超逸、技术员李成钢和杨靖群,以及研究生余建军和毛仁波,通讯作者饶毅。
刘子怡等研究的分子是LKB1,所谓“肝激酶B1”。它是蛋白激酶,但它并非肝脏特异的,而在很多器官有表达,包括脑。
LKB1的重要性,在1997年被发现。1921年和1949年,两位科学家发现一种提高多种组织癌症危险的胃肠道息肉的疾病,被称为Peutz-Jeghers 综合症(PJS)。1997年和1998年,LKB1基因突变被发现是PJS的致病原因,因此LKB1是抑癌基因。其缺失导致胃肠道肿瘤、肺腺瘤、子宫颈癌、卵巢癌、乳腺癌、胰腺癌和黑色素瘤。
LKB1基因编码的蛋白质是一种蛋白激酶。那么它磷酸化什么底物呢?2003年,英国和美国科学家们发现LKB1可以磷酸化AMPKα的T172位点。AMPK是代谢调控的重要蛋白激酶。一般认为AMPK有十几种相关蛋白质,被称为AMPK相关激酶(ARKs)。2004年,英国和芬兰科学家认为LKB1可以磷酸化当时认为的全部(14个)ARKs。
2016年,日本科学家通过遗传筛选,发现老鼠的SIK3影响睡眠。他们发现,如果SIK3因为突变而功能增加,老鼠的睡眠增加。也就是说,SIK3促进睡眠。他们发现果蝇的SIK3也有类似作用。他们后来还发现,如果老鼠的SIK1和SIK2有类似SIK3的功能增加的突变,也可以导致老鼠睡眠增加。
饶毅实验室的研究生李扬、博士后刘玉祥等发现,基因剔除老鼠的SIK3后,睡眠减少。基因剔除SIK1和SIK2不影响老鼠睡眠。也就是说只有内源的SIK3参与睡眠调控,而SIK1和SIK2在生理情况下不调控老鼠睡眠(李扬等,审稿中)。
饶毅实验室的博士后刘玉祥和研究生王涛、技术员崔云凤等发现,虽然从HEK培养细胞中拉下来的LKB1可以磷酸化SIK3,但是细菌表达的重组LKB1能够磷酸化AMPK而不能磷酸化SIK3。他们因此研究并发现了更多的磷酸化ARK的蛋白激酶(刘玉祥等,2022a,2022b)。
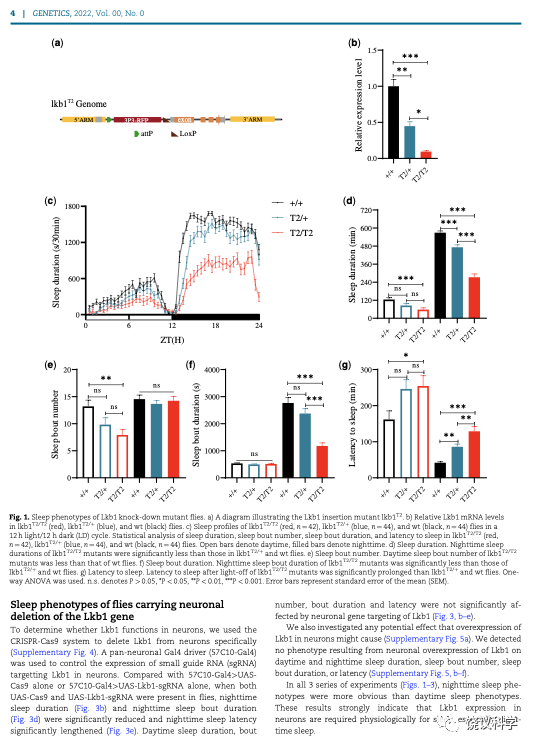
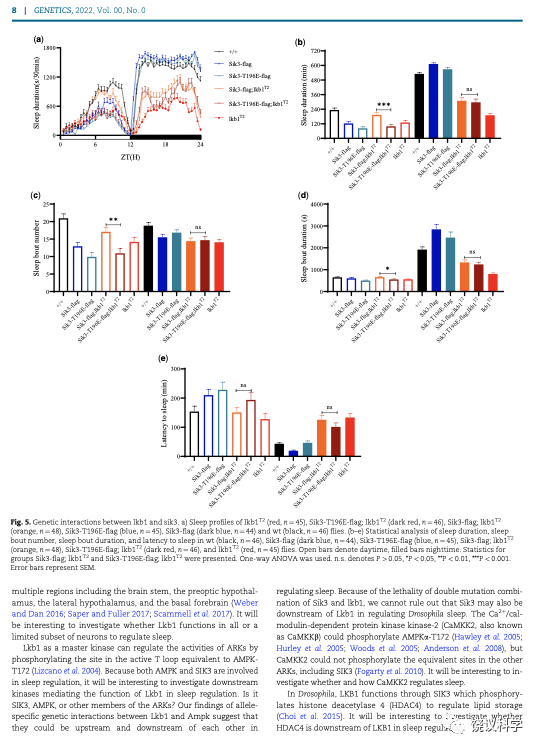
刘子怡等分析了老鼠和果蝇的基因突变造成的LKB1功能降低。LKB1的基因不能完全缺失。如果完全缺失后,果蝇和老鼠都在胚胎期就死亡,无法分析成年动物中LKB1对睡眠的作用。刘子怡等成功地拿到了LKB1含量大大降低的突变株。
她们发现,随着LKB1基因突变带来其mRNA表达减少,睡眠减少,无论在果蝇、还是在老鼠。
这些结果表明LKB1从果蝇到老鼠都具有保守的、调控睡眠的作用。对果蝇睡眠的影响特别在夜晚,睡眠总时间减少,关灯到睡眠的潜伏期延长,每段睡眠时间减少。这些作用有剂量依赖效应,杂合体果蝇也有部分减少。而这种量效关系与mRNA表达水平呈相关性。转基因引入野生型LKB1可以挽救突变株的睡眠表型。
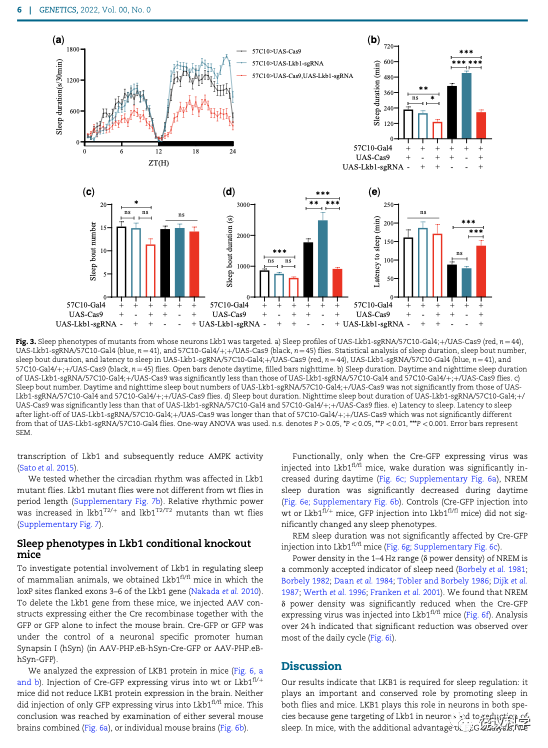
如果只在果蝇的神经细胞剔除LKB1基因,也出现类似的睡眠表型。但是单纯在野生型果蝇的神经细胞过度表达LKB1,看不见表型。
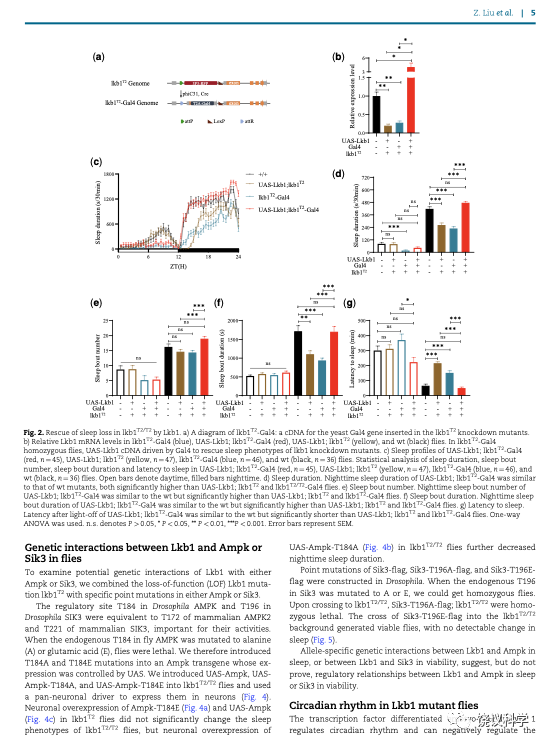
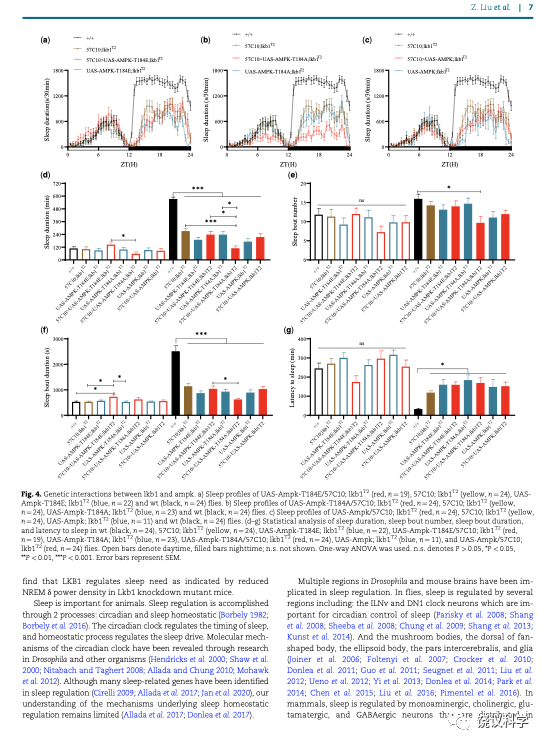
果蝇AMPK的T184相当于哺乳动物的T172位点。这个位点如果是野生型的T、或突变的E,在野生型果蝇没有影响,但如果在LKB1已经下降的情况下,再引入AMPK T184A,果蝇的睡眠进一步下降。这种位点特异的遗传相互作用,提示--但不证明--LKB1和AMPK可以有睡眠方面的功能关系。SIK3同类突变与LKB1没有显示睡眠方面的遗传相互作用。SIK3同类突变与LKB1在致死方面显示遗传相互作用。
虽然以前有研究显示转录因子DEC1可以调节昼夜节律,而且可以降低LKB1的基因转录,从而降低AMPK活性,刘子怡等没有观察到LKB1参与果蝇的昼夜节律生物钟。
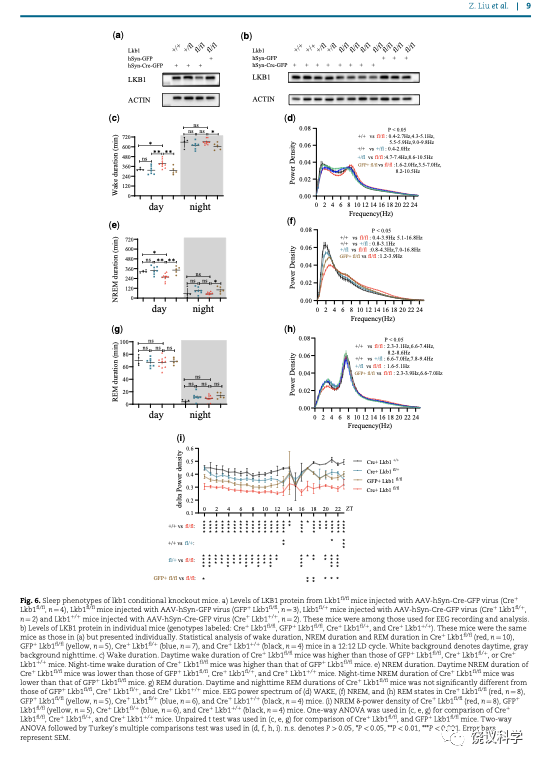
刘子怡等用条件性敲除LKB1基因的老鼠,通过成年注射病毒而导致老鼠脑内神经元缺失LKB1基因。他们发现这样之后,老鼠白天(老鼠正常睡眠时段)的睡眠减少,特别是非快动眼睡眠(NREM)减少。而几种对照组不出现这一表型。快动眼睡眠(REM)也不受影响。指针睡眠需求的NREM之δ功率密度,在神经细胞减少LKB1之后,也显著降低,说明LKB1对于睡眠需求是必需的。
刘子怡等的研究表明,LKB1对于果蝇和老鼠的都是必需的,而且在两种动物都是在神经细胞内调控睡眠。因为有脑电图帮助分析,在老鼠还可以发现LKB1促进睡眠需求。
LKB1下游到底是什么,AMPK是一种可能,但证据比较间接(遗传相互作用)。LKB1在什么细胞起调控睡眠的作用?哪些神经细胞?神经细胞之外是否还有其他细胞?神经系统之外是否就完全与睡眠无关?
AMPK对代谢很重要。LKB1调控睡眠是否与调控代谢有关?什么关系?平行还是上下游?
(2017-2022)饶毅实验室6篇睡眠相关论文
1)Qian YJ, Cao Y, Deng BW, Yang G, Li J, Xu R, Zhang D, Huang J and Rao Y (2017). Sleep homeostasis regulated by 5HT2b receptor in a small subset of neurons in the dorsal fan-shaped body of Drosophila. eLife 6:e26519.
2)Zhang X, Yan HM, Huang ZL and Rao Y (2018). Independence of 5HT involvement in sleep and arousal from thermoregulation in mice. Mol Pharmacol 93:657-664.
3)Deng BW, Li Q, Liu XX, Cao Y, Li BF, Qian YJ, Xu R, Mao RB, Zhou EX, Zhang WX, Huang J and Rao Y (2019) Chemoconnectomics: mapping chemical transmission in Drosophila. Neuron 101:876-893.
4)Dai XHM, Zhou EX, Yang W, WX Zhang and Rao Y (2019). D-Serine promotes sleep through the NMDA receptor in Drosophila melanogaster. Nature Communications 10:1986.
5)Dai XHM, Zhou EX, Yang W, Deng BW, Li Q, Liu XX, Zhang WX and Rao Y (2021). Molecular resolution of a behavioral paradox: sleep and arousal are regulated by distinct acetylcholine receptors in different neurons of Drosophila. Sleep 10, 1093.
6)Liu ZY, Jiang LF, Li CY, Li CG, Yang JQ, Yu JJ, Mao RB and Rao Y (2022). LKB1 is physiologically required for sleep from Drosophila melanogaster to the Mus musculus. Genetics 221, iyac082.
最新文章
LKB1 is known as a master kinase for 14 kinases related to the adenosine monophosphate (AMP)-activated protein kinase (AMPK). Two of them (SIK3 and AMPKa) have previously been implicated in sleep regulation. We generated loss-of-function (LOF) mutants for Lkb1 in both Drosophila and mice. Sleep, but not circadian rhythms, was reduced in Lkb1-mutant flies and in flies with neuronal deletion of Lkb1. Genetic interactions between Lkb1 and AMPK T184A mutants in Drosophila sleep or those between Lkb1 and SIK3 T196A mutants in Drosophila viability have been observed. Sleep was reduced in mice after virally mediated reduction of Lkb1 in the brain. Electroencephalography (EEG) analysis showed that non-rapid eye movement (NREM) sleep and sleep need were both reduced in Lkb1-mutant mice. These results indicate that LKB1 plays a physiological role in sleep regulation conserved from flies to mice.