闫致强课题组发现SARS-CoV-2E蛋白通道活性及该通道抑制剂,为COVID-19候选药物的研发提供潜在重要靶点
2021年8月25日,深圳湾实验室闫致强课题组在BioRxiv发布了科学论文, ”Structure-based screening of drug candidates targeting the SARS-CoV-2 envelope protein”。该研究通过电生理记录,确定了新型冠状病毒SARS-CoV-2的疏水包膜蛋白(Envelope protein,E蛋白)的阳离子选择性通道活性,验证了SARS-CoV E蛋白阻断剂HMA (hexamethylene amiloride)同样可以抑制SARS-CoV-2 E蛋白,并进一步利用同源建模和虚拟筛选从5000多个化合物中发现了AZD5153,通过电生理验证其对SARS-CoV-2 E蛋白的抑制作用并确定了AZD5153敏感性氨基酸位点。上述结果为COVID-19治疗药物的研发提供了重要潜在靶点,SARS-CoV-2 E蛋白抑制剂HMA 和AZD5153的发现,使老药新用变得可行,降低新药研发的风险和研发成本,缩短开发周期。
截至2021年9月13日,已报道的COVID-19全球累计确诊人数超过2亿,死亡人数超过4百万,疫情造成了极大的健康危害和经济影响。自疫情爆发以来,各类疫苗和治疗性药物的研发迅速展开。SARS-CoV-2病毒主要有三种膜蛋白结构:刺突蛋白(Spike protein,S蛋白),膜蛋白(Membrane protein,M蛋白)和包膜蛋白(E蛋白)(图一)。研究表明,病毒中的离子通道蛋白对病毒的致病性起到至关重要的作用,并可以作为药物靶点,比如流感病毒的常用药物金刚烷胺为离子通道抑制剂[1]。严重急性呼吸综合征冠状病毒(SARS-CoV)E蛋白的离子通道活性对病毒的致病性和发病机制至关重要,包括水肿的形成,而水肿是肺损伤和急性呼吸窘迫综合征(ARDS)的主要决定因素[2-3]。SARS-CoV和SARS-CoV-2的E蛋白序列具有很高的同源性,鉴于此,SARS-CoV-2的E蛋白很可能也是离子通道并对病毒的致病性至关重要。因此,课题组将关注点集中到SARS-CoV-2 E蛋白,探究其作为潜在治疗靶点的可能性。
图一 SARS-CoV-2病毒表面结构示意图
为了探究SARS-CoV-2 E蛋白是否确实具有离子通道活性,课题组将合成的SARS-CoV-2 E蛋白的基因序列克隆到表达载体,在CHO-K1细胞中表达并进行全细胞电生理记录,发现在电压刺激下,表达SARS-CoV-2 E蛋白的CHO细胞被激发出了明显增大的内向电流和外向电流。随后进行的离子选择性电生理实验,表明该通道可转导一价阳离子。
SARS-CoV-2 E蛋白的离子通道活性得到确定,证实了其成为药物治疗靶点的可能性。课题组希望筛选得到SARS-CoV-2 E蛋白的通道抑制剂,作为治疗COVID-19的药物或者前体在疾病的干预中得到应用。研究表明,临床心血管药物阿米洛利(amiloride)的衍生物HMA可以阻断SARS-CoV E蛋白的离子通道活性,抑制病毒复制[4-5]。利用膜片钳记录,我们检测到HMA同样可以抑制SARS-CoV-2的E蛋白离子通道活性。进一步,课题组通过同源建模,得到了SARS-CoV-2 E蛋白的五聚体结构模型,每个亚基由N端、C端和一个单个跨膜结构域(TMD)组成(图二 A)。在此结构基础上,建立了SARS-CoV-2 E蛋白和HMA的结合模型,预测得到两种结合口袋,分析了其中的关键氨基酸残基对(图二 B),并对这些预测的关键位点突变进行电生理验证。
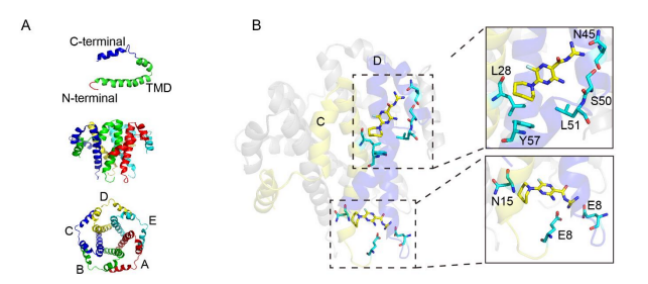
图二 SARS-CoV-2 E蛋白和HMA药物的结合模型
(A) SARS-CoV-2 E蛋白的五聚体结构模型。(B)HMA与SARS-CoV-2 E蛋白的结合模型。
老药新用可以降低新药研发的风险,降低整体成本和开发周期。因此,课题组利用构建的SARS-CoV-2 E蛋白结构模型,通过虚拟筛选,从上市药物库、临床期药物库以及天然药物库三个化合物库共5000多个化合物中筛选到35个候选化合物并通过电生理记录测试其功能。其中,一种在临床试验中用于抗血液系统恶性肿瘤的溴域蛋白抑制剂 AZD5153,在40μM浓度下可以抑制SARS-CoV-2 E蛋白的电流。在对预测的关键氨基酸残基进行电生理验证时,发现Phe23和Val29是AZD5153敏感性的关键决定因素,进一步证实了预测的结合模型(图三)。
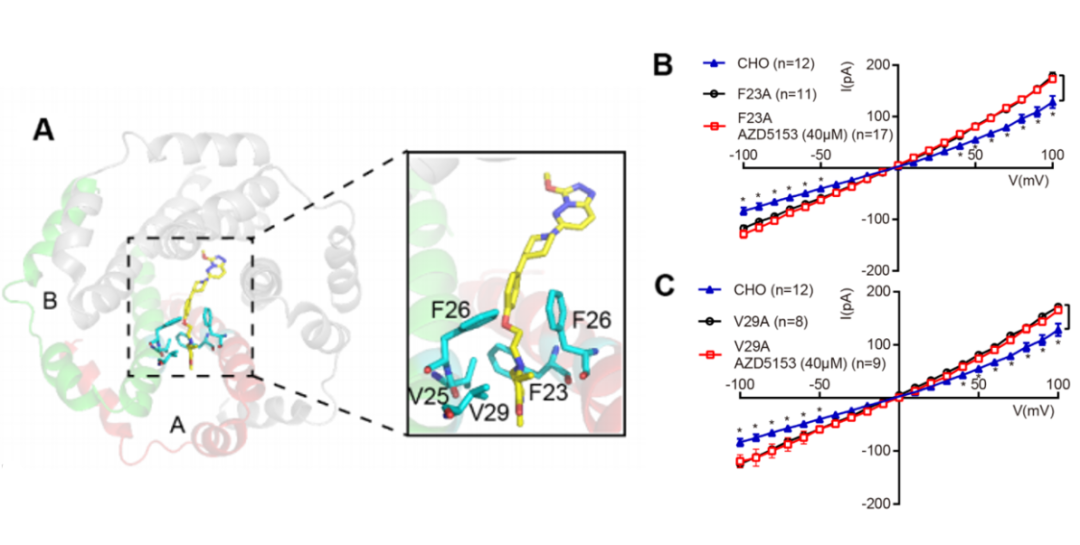
图三 AZD5153抑制SARS-CoV-2E蛋白通道活性
(A) AZD5153与SARS-CoV-2 E蛋白的结合模型。 (B-C)突变体F23A(B)、V29A(C)在有或没有40μM AZD5153条件下的电流-电压关系。
上述研究,证实了SARS-CoV-2 E蛋白的离子通道活性,并确定了其通道活性抑制剂HMA和AZD5153。进一步的,通过结构模型分析并利用电生理手段验证了两种药物与SARS-CoV-2 E蛋白的结合模型。HMA和AZD5153作为先导化合物,以此开发SARS-CoV-2 E蛋白的抑制剂,可以极大的降低新药研发的风险和研发成本,缩短开发周期。此外,通过对培养细胞的膜片钳记录进行SARS-CoV-2 E蛋白的功能试验的方式,为筛选FDA批准药物作为治疗COVID-19的潜在候选药物提供了机会。
复旦大学博士夏昕为本文第一作者。深圳湾实验室闫致强研究员为本论文的通讯作者。闫致强实验室的博士生张玉玮、李松凌,硕士生林恒威参与了该项研究并做出重要贡献。本工作得到了国家干细胞转化研究重点研发计划、国家自然科学基金、上海市科技重大项目,复旦大学,深圳湾实验室等方面的资助和支持。
参考文献
1. Nieva, J. L., Madan, V., and Carrasco, L. (2012) Viroporins: structure and biological functions. Nat. Rev. Microbiol. 10, 563-574
2. Wilson, L., McKinlay, C., Gage, P., and Ewart, G. (2004) SARS coronavirus E protein forms cation selective ion channels. Virology 330, 322-331
3. Nieto-Torres, J. L., DeDiego, M. L., Verdia-Baguena, C., Jimenez-Guardeno, J. M., Regla-Nava, J. A., Fernandez-Delgado, R., Castano-Rodriguez, C., Alcaraz, A., Torres, J., Aguilella, V. M., and Enjuanes, L. (2014) Severe acute respiratory syndrome coronavirus envelope protein ion channel activity promotes virus fitness and pathogenesis. PLoS Pathog. 10, e1004077
4. Wilson, L., Gage, P., and Ewart, G. (2006) Hexamethylene amiloride blocks E protein ion channels and inhibits coronavirus replication. Virology 353, 294-306