回国十六年来饶毅实验室可归为化学连接组(CCT)总体框架下的论文达十篇:八篇研究神经递质及其受体在行为方面起功能的论文;2019年一篇明确提出化学连接组概念、建立第一套化学连接组方法的文章;2023年12月刚发表一篇方法学进一步改进、工具进一步完善的论文。
2019年3月6日,饶毅实验室的邓博文等发表论文,提出化学连接组概念和化学连接组的研究途径。神经系统内、神经系统与靶器官之间,通过化学神经递质进行信息传递。饶实验室提出将个体所有神经递质、及其相关的受体、合成酶、降解酶、转运蛋白的集合作为整体,为化学连接组(chemoconnectome,CCT),而制造所有相关基因的敲除、标记、操纵元件来研究神经化学传递参与行为的方法称为化学连接组学(chemoconnectomics,CCTomics)。他们在果蝇中建立了对CCTomics重要的果蝇品系。
2023年12月19日,饶毅实验室的毛仁波等发表论文,进一步深化CCTomics,建立了条件性的化学连接组学(cCCTomics),可以有选择、有条件地敲除和调控CCT,从而提供更为精确时间空间研究化学传递的工具。他们以生物钟为例,用cCCTomics发现了更多参与生物钟的神经递质、神经肽及其受体,也研究了相关细胞及其对于生物钟精细环节(如预计清晨行为)的分子和细胞机理。
博士生毛仁波为第一作者,其他作者包括博士生余建军、博士后邓博文、博士生戴熙慧敏、副教授张文霞等。饶毅为通讯作者。
他们的工作目前是基于果蝇,实际从概念到方法都可以应用于小鼠。今年有人用线虫实际做了他们做的一个子集(神经肽),目标一致。
连接组是指动物神经系统内的全部神经连接。2019年, 饶毅实验室定义了化学连接组(Chemoconnectome, CCT)的概念, 它包括所有神经递质及其受体以及它们所包含的神经环路(Deng et al., 2019)。邓博文等还在果蝇中首次建立了化学连接组工具系统(Chemoconnectomics, CCTomics), 包括所有神经递质、调质其受体基因的敲除品系和 3’端敲入的GAL4/LexA 品系。该系统可以通过突变体筛选和 CCT 神经元操纵进行基因、神经元功能和相关的行为研究,是一种基于CCT基因的解析神经环路的方法。
在上述的CCTomics方法中,尚有一些限制:诸如乙酰胆碱合成酶、谷氨酸转运体、伽马氨基丁酸受体等基因突变致死从而无法对这些基因进行功能研究;同时,细胞特异的基因操纵对于神经环路解析非常重要,也尚不包含在已建立的工具库中。
在近期新的工作中, 毛仁波利用GFP RNAi、Flp-out 和 CRISPR/Cas9 三种不同的策略, 建立了一系列包含数百个转基因或基因敲入品系的果蝇文库, 即条件性化学连接组工具库(Conditional Chemoconnectomics, cCCTomics),通过这个工具库的进一步应用,毛仁波还发现了神经肽CNMa及其受体CNMaR对于果蝇晨间活动的有趣调控作用。
首先,毛仁波设计了结合GFP RNAi((Neumüller et al., 2012)和Flp-out(Vetter et al., 1983)CCT基因原位敲入的策略(Fig 1A)。通过荧光成像和行为测试, 毛仁波发现几乎所有8个测试基因都被完全敲除/敲低(Fig 1, Fig S1)。不过该策略也有一些限制性, 比如需要相对复杂的遗传重组以及部分基因在C端敲入GFP-FRT之后会影响原基因的功能。因而,该系统适用于一些特定基因功能的验证和进一步分析,不适合条件性敲除的筛选工作。为了进一步完善对于CCT基因的条件性操纵, 毛仁波开发了基于CRISPR/Cas9的条件性敲除系统。
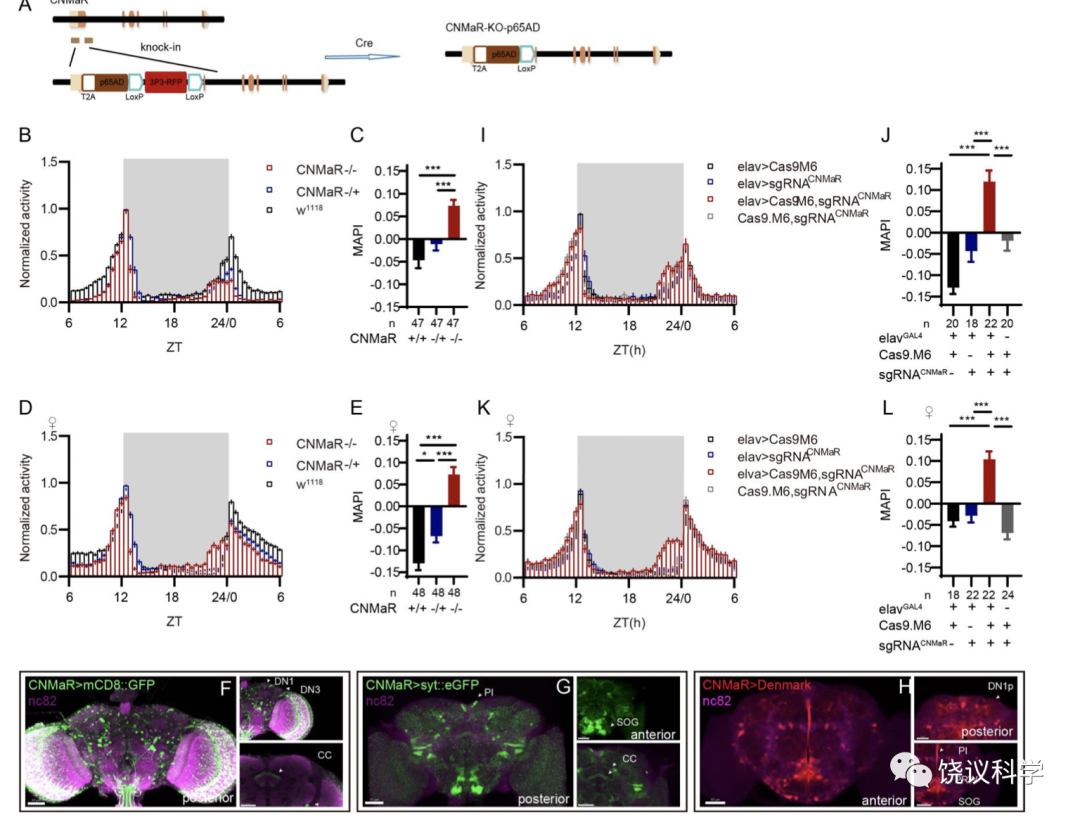
CRISPR/Cas9系统在毛仁波之前就已被用于果蝇基因的条件性操纵, 并在不同情况下取得了有效的结果(Port et al., 2016;Port et al., 2019;Schlichting et al., 2019;Delventhal et al., 2021;Koreman et al., 2021;Schlichting et al., 2022)。尽管在以往的应用中, CRISPR/Cas9 在神经系统中的有效性得到了一定程度的验证, 但仍缺乏一些系统性的验证。此外, 当毛仁波在应用原始的CRISPR/Cas9系统对 nAChRα2 和 nAChRβ2 在神经元中进行基因敲除时, 这些果蝇并未复现在其各自的基因突变体中观察到的有关睡眠显著降低的表型(Dai et al., 2022; Fig 2)。这引发了毛仁波对原始 CRISPR/Cas9 系统在特定基因操纵效率上的担忧。
在毛仁波新建立的cCCTomics中, 毛仁波结合以往文献报道(Port and Bullock, 2016; Xie et al., 2015; Ding et al., 2019; Zhao et al., 2016等等,参见论文),在果蝇中开发了一种修饰的 CRISPR/Cas9 系统, 其中包含了对 Cas9 蛋白和 sgRNA 骨架的改变。毛仁波系统地评估了该策略在神经系统中的效率(Fig 3, Fig S5): 14 个靶基因的平均基因敲除效率超过了 90% (mRNA水平的检测)。值得注意的是, 由于部分CRISPR/Cas9引起的突变不一定会引起mRNA水平的变化,实际效率还有可能更高。此外, 通过二代测序, 毛仁波发现修饰后的 Cas9 在 19 个测试的靶位点中显示出更高的编辑能力(Fig S6. Mao et al., 2023)。这些发现为利用CRISPR/Cas9对果蝇进行精确的基因条件性敲除,尤其是神经系统中的基因条件性敲除提供了有效的参考方案。
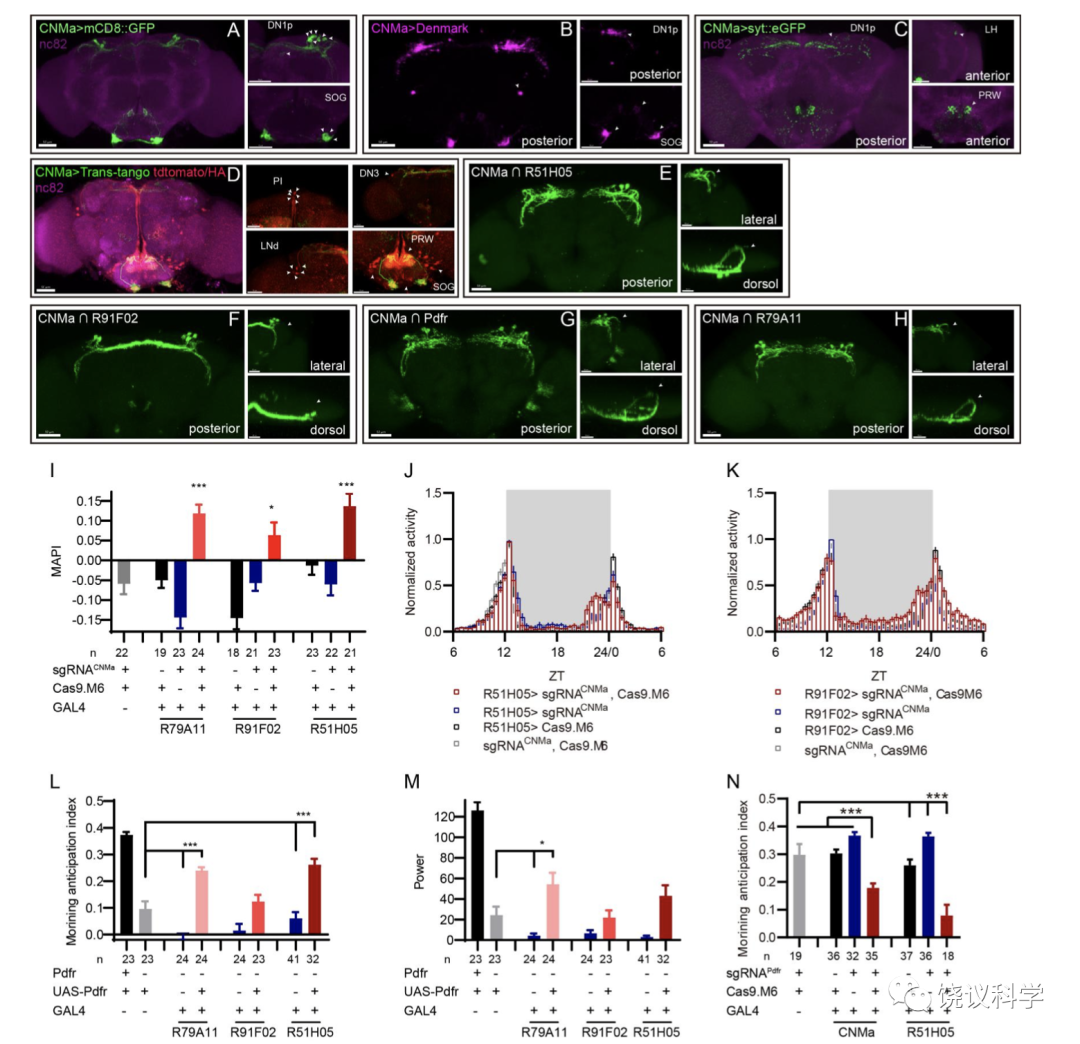
在该工作中,毛仁波还进一步利用2019年实验室开发的CCTomics的GAL4/LexA品系,对生物钟神经元进行了其CCT基因表达特征分析(Fig 4, Fig S7, Fig S8, Table S4),并利用CRISPR/Cas9系统对在生物钟神经元中表达的CCT基因进行了神经元特异性敲除(Table S6)。在这部分应用的工作中,毛仁波发现神经肽 CNMa 及其受体(CNMaR)在果蝇对于早晨来临的预期(morning anticipation,MA)中有抑制作用: 这两个基因的突变体或者DN1p神经元中突变CNMa都会引起果蝇的黎明时期的活动增强并伴随着活动峰值的前移(advanced morning activity peak) (Fig 5-, Fig S9-S11)。非常有趣的是,经典的PDF-PDFR信号的缺失会导致果蝇对于夜晚来临的预期(evening anticipation, EA)提前,同时导致MA的消失,表明PDF-PDFR信号对于EA的抑制作用以及MA的促进作用(Hyun et al., 2005),后者与CNMa-CNMaR对MA的调控作用上相反。
总的来说,新建立的cCCTomics推进了果蝇中研究CCT基因的工作,cCCTomics 策略允许研究人员在特定的神经元中进行基因功能研究, 规避了一些化学递质基因突变致死而无法对其进行研究的问题。修饰后的CRISPR/Cas9系统也不仅仅局限于CCT基因编辑,也可以更有效的对其他基因进行细胞特异的操纵。同时,毛仁波等也进一步发现果蝇节律活动的调节是精细而有趣的。
cCCTomics设计的基本原理: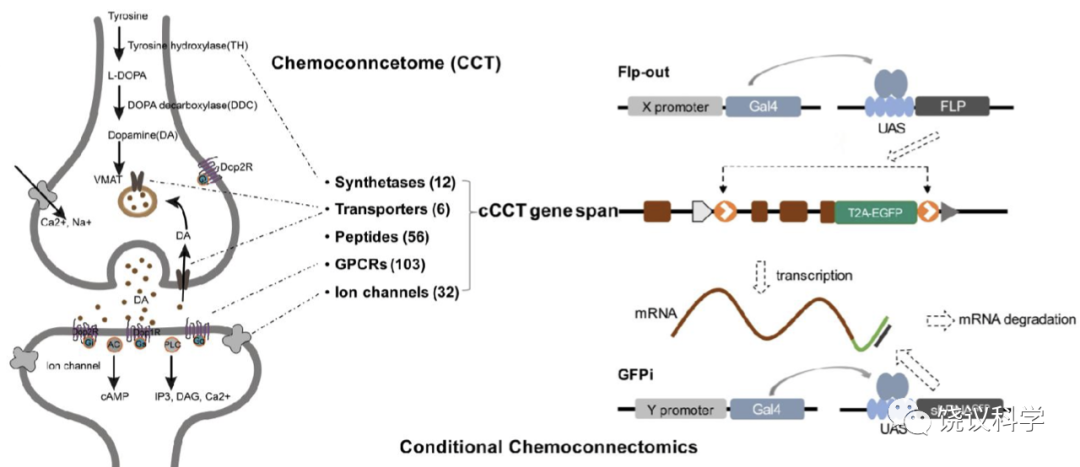
cCCTomics的设计高效: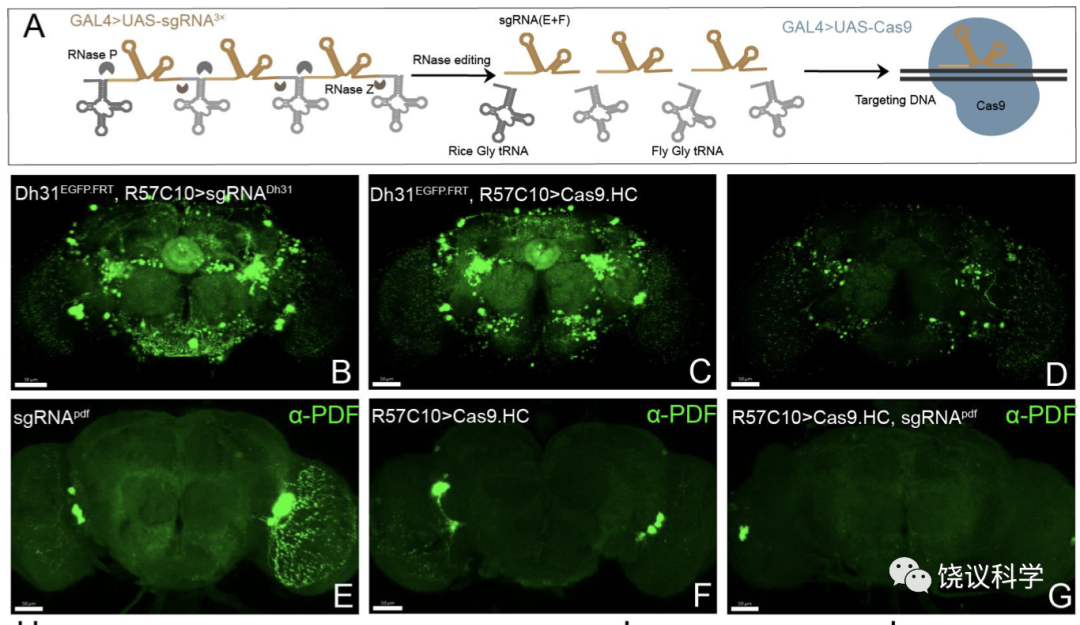
cCCTomics所用元件的优化: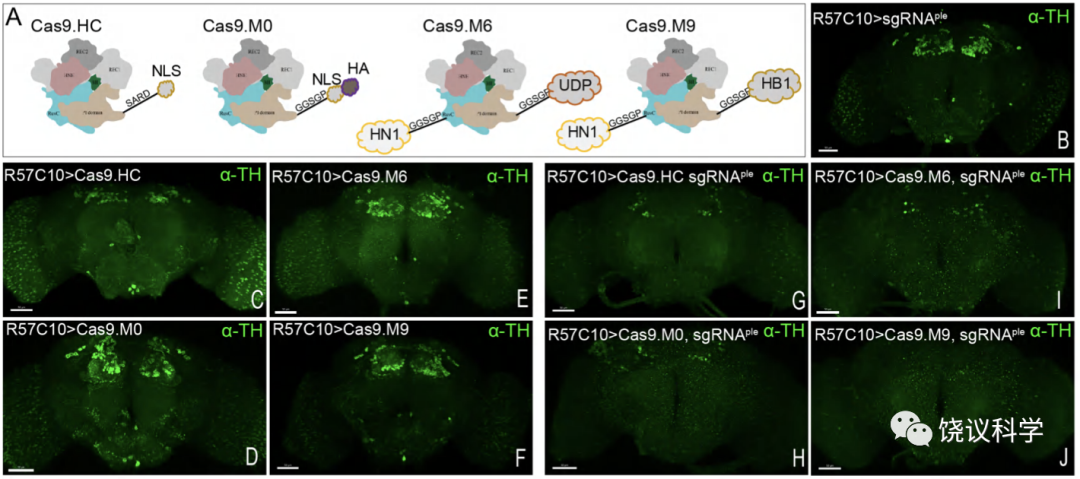
以生物钟为例应用cCCTomics:
通过cCCTomics发行参与生物钟的新的分子及其相关细胞: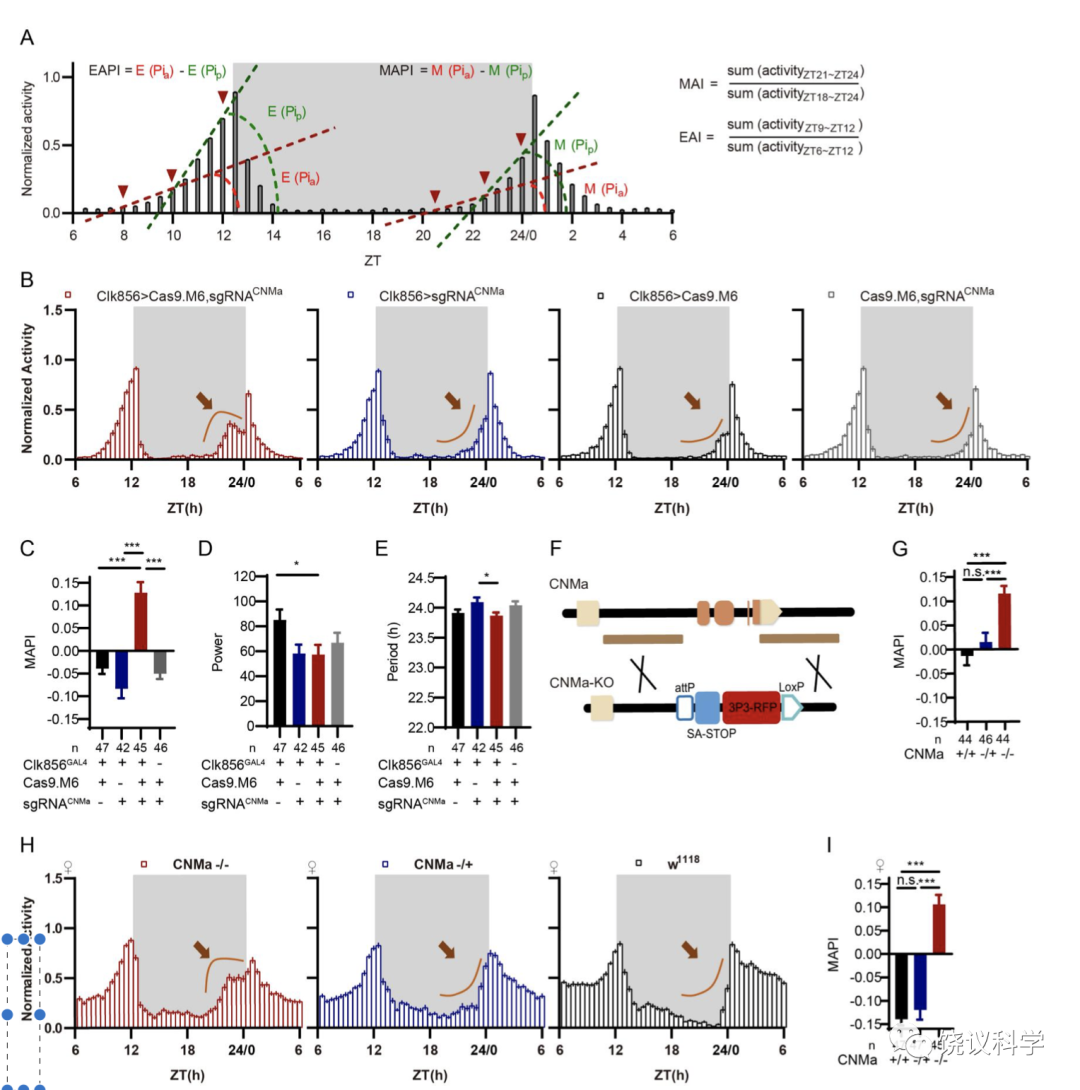
饶实验室的研究未沾染中国脑计划。
饶毅实验室CCTomics方法学论文:
1) Deng BW, Li Q, Liu XX, Cao Y, Li BF, Qian YJ, Xu R, Mao RB, Zhou EX, Zhang WX, Huang J and Rao Y (2019) Chemoconnectomics: mapping chemical transmission in Drosophila. Neuron 101:876-893.
2) Mao R, Yu J, Deng B, Dai X, Du Y, Du S, Zhang WX and Rao Y (2023). Conditional chemoconnectomics: a set of libraries targeting all chemical transmission corresponding genes efficiently. eLife 12:RP91927 (bioRxiv2023.09.26.559642).
饶毅实验室发表的CCT所含神经递质及其受体功能相关论文:
3) Zhou C, Rao Y and Rao Y (2008). A subset of octopaminergic neurons are important for Drosophila aggression. Nat Neurosci 11:1059-1067.
鱆胺参与果蝇打架。
4) Liu Y, Jiang Y, Si Y, Kim J-Y, Chen Z-F and Rao Y (2011). Molecular regulation of sexual preference revealed by genetic studies of 5-HT in the brain of male mice. Nature 472:95-99.
五羟色胺控制雄鼠交配的选择。
5) Zhou C, Huang H, Kim SM, Lin H, Meng X, Chiang A-S, Wang JW, Jiao R and Rao Y (2012) Molecular genetic analysis of sexual rejection: roles of octopamine and its receptor OAMB in Drosophila courtship conditioning. J Neurosci 32:14281-14287.
鱆胺及其受体之一OAMB参与对交配后拒绝的反应。
6) Zhang SS, Liu Y and Rao Y (2013). Serotonin signaling in the brain of adult female mice is required for sexual preference. Proc Natl Acad Sci 110:9968-9973.
五羟色胺控制雌鼠交配的选择。
7) Qian YJ, Cao Y, Deng BW, Yang G, Li J, Xu R, Zhang D, Huang J and Rao Y (2017). Sleep homeostasis regulated by 5HT2b receptor in a small subset of neurons in the dorsal fan-shaped body of Drosophila. eLife 6:e26519.
五羟色胺受体2b在一对神经元中参与控制果蝇睡眠。
8) Zhang X, Yan HM, Huang ZL and Rao Y (2018). Independence of 5HT involvement in sleep and arousal from thermoregulation in mice. Mol Pharmacol 93:657-664.
五羟色胺参与调节小鼠睡眠。
9) Dai XHM, Zhou EX, Yang W, WX Zhang and Rao Y (2019) D-Serine promotes sleep through the NMDA receptor in Drosophila melanogaster. Nat Comm 10:1986.
D型丝氨酸通过NMDA受体参与调控果蝇睡眠。
10) Dai XHM, Zhou EX, Yang W, Deng BW, Li Q, Liu XX, Zhang WX and Rao Y (2021). Molecular resolution of a behavioral paradox: sleep and arousal are regulated by distinct acetylcholine receptors in different neurons of Drosophila. Sleep 10:1093.
同一个神经递质(乙酰胆碱)通过不同受体调控果蝇的睡眠和觉醒。