《生物学概念与途径》后门几章着重途径、方法
14 分子生物学筛选
分子生物学的发展,不断推出新的技术,有助于筛选参与重要生物学功能的基因,从而进一步揭示分子机理。
可以是通过增加基因功能,来发现有某种功能的基因,也就是gain of function (GOF)的筛选,如根据基因表达时间、空间来发现,可以有多种“表达克隆”的方法。也可以通过降低基因的功能,来发现参与某种功能的基因,loss of function (LOF)的筛选。GOF有助于发现对于功能充分的基因,LOF发现对功能必要的基因。
本章以一些重要的例子来说明这些方法及其应用。
14.1 按表达时间找基因
根据基因表达的时间,加上功能检测,是寻找重要的基因的一种方法。
C3H 10T1/2 C18是来自小鼠胚胎,为研究癌症而衍生的细胞系。1977年,几位科学家用它筛选多种癌症化疗药物的作用,偶尔发现,胞嘧啶的衍生化合物5-氮杂胞苷(5-azacytidine,aza) 处理后,出现长长的多核细胞(Benedict et al., 1977)。已知aza有抑菌、抗癌、诱变等作用,当时已用于治疗白血病。南非科学家Constantidines、Jones和Gevers等证明,aza处理10T1/2细胞后出现的是肌肉细胞(Constantidines, Jones and Gevers, 1977)。10T1/2细胞和3T3细胞都可以被aza诱导产生,有时不仅肌肉细胞,而且还有脂肪细胞等(Taylor and Jones, 1979)。因为aza抑制甲基转移酶活性,推测是它抑制DNA甲基化而影响基因表达让细胞可以重新改变命运。
1986年,美国西雅图Fred Hutchinson癌症研究中心的Harold Weintraub (1945-1995) 实验室用这一模型研究决定肌肉细胞的基因。首先,Weintraub的博士后Andrew Lassar等证明,aza处理的10T1/2细胞不仅有肌肉细胞的形态特征,而且肌肉细胞应该表达的分子如肌球蛋白、乙酰胆碱受体、肌肉特异的肌动蛋白等也都表达了,所以是货真价实的肌肉细胞。之后,Lassar等从aza处理10T1/2细胞后得到的肌肉细胞提取基因组DNA,而这些DNA转染没有经过aza处理的10T1/2细胞,可以得到肌肉细胞。而未经aza处理的10T1/2细胞来的基因组DNA缺乏这一作用。从另外一种已知的肌肉细胞系C2C12来源的基因组DNA,也有这一作用。他们从转染得到肌肉细胞的频率推测单个基因起了改变细胞命运的作用(Lassar, Paterson and Weintraub, 1986)。
Weintraub的研究生Robert Davis加入研究。1987年,Davis、Lassar和Weintraub报道,他们找到了将10T1/2成纤维细胞变成肌肉细胞的单一基因(Davis, Weintraub and Lassar, 1987)。他们寻找的过程,关键是比较aza处理前后的基因差别。他们用来自aza处理后的10T1/2细胞的mRNA,制备32P标记的cDNA探针(我们在此称为A),也用肌肉细胞系C2C12的mRNA制备cDNA(我们在此称为B)。Davis等也用没有处理的10T1/2细胞的mRNA制备cDNA(我们在此称为C)。单链的DNA与双链的DNA早就有技术在羟基磷灰石柱(hydroxyapatite,HAP)上分离(Bernardi,1965)。Davis等杂交A和C后,过HAP柱,选择单链的cDNA留下,就是只在aza处理后10T1/2细胞变成的肌肉细胞特异的(我们在此称为D)。多次过柱,以提高选择性。得到10T1/2细胞变成的肌肉特异的探针D,再与B进行杂交,杂交后,过HAP柱,选择双链的cDNA,也多次过柱选择双链,得到A和B共同的cDNA。这样,最后拿到的就是A与B共同、而与C不同的cDNA。因为其来自poly (A)+ RNA (mRNA),所以是不同的mRNA。Davis等同样也用B制备32P标记的cDNA探针,找其与A相同、与C不同的部分。
他们因此从104个cDNA中找到92个肌肉有、成纤维细胞没有的克隆,基因序列为26种。他们进一步加几个标准:在10T1/2细胞完全不表达,从肌肉母细胞分化到肌管过程表达不变化以排除肌肉终分化过程的基因、聚焦早期决定肌肉命运的基因等。符合所有这些标准的只有三个基因,他们分别称为MyoA、MyoD和MyoH。这三个基因分别单独转染10T1/2细胞,只有MyoD可以让他们变成肌肉细胞。而且MyoD可以使多种细胞变成肌肉细胞(Davis, Weintraub and Lassar, 1987)。在鼠体内,MyoD只在有肌肉细胞的组织和器官表达。机理上,MyoD蛋白质是控制mRNA生成的转录因子(Lassar et al., 1989)。以后的研究证明MyoD类似的多个基因控制肌肉形成。这一研究成为细胞命运分子机理的典范。
14.2 按表达空间找基因
根据基因表达的空间,也可以寻找基因。

如第五章所述,脊椎动物如两栖类的胚胎早期,与卵母细胞一样,有动物极和植物极。两者不仅外观着色可以不同,而且如果受精后会成为不同的胚胎部分,植物极的细胞还向动物极的细胞发出分子信号,例如在动物极与植物极之间的边缘区产生中胚层及其衍生的组织细胞(Nieuwkoop, 1969; Nieuwkoop and Ubbels, 1972)。
哈佛大学Douglas Melton实验室决定专门寻找卵细胞植物极和动物极特异的mRNA。他们用卵细胞的mRNA,反转录为cDNA,制成含量2x106的cDNA文库 (Rebagliati et al., 1985)。他们切下动物极和植物极,分别制备mRNA,然后做32P标记的探针。用这些探针分别与卵细胞cDNA文库的模板杂交,寻找两极特异的mRNA。他们找到3个动物极特异的mRNA (分别命名为An1、An2、An3)和一个植物极特异的mRNA (Vg1)。他们进一步分析Vg1,发现它编码一个分泌性的蛋白质,属于转化分化因子(TGF-b)家族(Weeks and Melton, 1987)。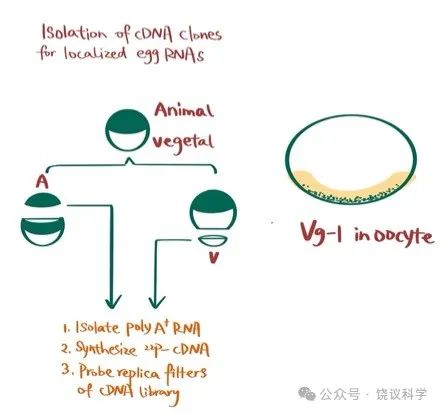

如第五章所述,胚胎发育的一个重要过程是形成腹背轴。两栖类的背轴含很多结构。虽然背轴在比较肠胚期才比较容易从外观看见,但其决定却在很早,例如爪蟾胚胎可能在受精过程因为精子进入位点就确定了其对侧为背侧(Gerhart et al., 1989)。寻找可以决定背轴的基因的一个方法是到早期胚胎的背侧去找有背唇化功能的基因。已知用紫外线(UV)处理1细胞期的爪蟾胚胎可以导致胚胎的腹侧化(Gimlich and Gerhart, 1984),而用氯化锂(LiCl)处理1细胞期的爪蟾胚胎可以导致胚胎的背侧化(Kao, Masui and Elinson, 1986)。美国伯克利加州大学的Richard Harland与博士后William Smith从不同胚胎提取mRNA,注射到UV处理过的胚胎,检测它们能否让腹侧化的胚胎背侧化(形成背轴) (Smith and Harland, 1991)。他们比较了几种来源的mRNA,发现作用最强的是LiCl处理过的胚胎来源的mRNA(成功率46%),其次是正常胚胎来源的mRNA(成功率12%),而腹侧化胚胎来源的mRNA具有的背侧化作用(成功率8%)类似于没注射mRNA的对照(成功率5%)。他们按分子量将作用最显著的mRNA分成几个组分,其中从组分8获得一个mRNA有背侧化作用,编码Xwnt8,但当时已经有人发现同类基因(Smith and Harland, 1991)。他们从组分9获得一个全新的基因,编码一个分泌性蛋白质,他们命名为Noggin (Smith and Harland, 1992)。Noggin最早表达在肠胚刚刚开始形成时期,而且在背唇。以后也在神经管中。这是第一个发现特异表达在背唇的基因。功能上,它不仅能够背侧化早期胚胎,而且可以有神经诱导作用。
美国洛杉矶加州大学的Eddy de Robertis实验室专门用背唇制备cDNA文库,然后注射mRNA,来寻找可以背侧化UV处理后胚胎的基因。他们发现Chordin,它也先表达在背唇,以后在神经管,并且也有神经诱导作用(Sasai et al., 1994)。
14.3 按功能特点寻找基因:蛙卵表达克隆
表达克隆,是典型的按照基因编码的蛋白质可能具有的功能,而克隆基因。
用于表达基因的细胞可以根据不同需要而定。用非洲爪蟾卵母细胞(以下简称卵母细胞),是其中一种(Mowry, 2020)。
将其他生物来源的基因,体外转录为mRNA后,注射到爪蟾卵母细胞,可以观察到mRNA被翻译为蛋白质(Gurdon et al., 1971)。但要能够用于表达克隆,例如某些神经递质或者激素的受体,不仅mRNA能够在卵母细胞表达、而且产物蛋白质能够上细胞膜,如果本身不能被检测到,就还需要其下游偶联的分子也存在,而能够在细胞外给予其激动剂时检测到反应。烟碱型乙酰胆碱受体(nAChR)本身是离子通道,可以上膜,形成可以被检测到的离子通道,用电鱼电器官获得的mRNA注射到卵母细胞,检测到了nAChR的反应(Sumikawa et al., 1981)。对哺乳类学习记忆至关重要的NMDA受体,就是用卵母细胞的表达克隆所找到的(Moriyoshi et al., 1991)。
五羟色胺有多种受体,其中5-HT1c受体也是离子通道,是通过卵母细胞的表达克隆而发现的(Lübbert et al., 1987; Julius et al., 1988)。从富含5-HT1c的肿瘤制备cDNA文库,注射mRNA有5-HT引起的氯离子通道形成,然后继续筛选直到一个cDNA。
神经肽K物质的受体不是离子通道,而是GPCR,但其下游偶联的信号转导通路有可以被检测的反应,也可以用卵母细胞克隆K物质的受体(Masu et al., 1987)。
电流检测之外,还有其他方法检测功能。例如,转运蛋白可以转运特异的底物,如果有可以同位素标记的底物(Hediger et al., 1987),或者现代化学分析仪器(质谱等)可以检测的底物,那么也可以用来表达克隆编码转运蛋白的基因。
14.4按功能特点寻找基因:钙信号检测
科学研究可以是聚焦一个科学问题、自然现象;也可以是科学家偏好一种技术,利用技术寻找可以由技术帮助解决的问题。

钱永健(Roger Tsien,1952-2016)以其化学和生物学背景,不断发明技术,用于生物学研究,带动技术发明逐渐成为生命科学的研究生涯。他发明钙离子检测的方法有特别的贡献。他先通过改造钙离子的螯合剂,使之在结合钙离子后发出荧光,从而用荧光强度变化检测活细胞内的钙离子浓度,有fura-2等一系列检测钙离子浓度的钙染料(Tsien, 1980, 1981)。在下村脩(Osamu Shimomura,1928-2018)(Shimomura, Johnson and Saiga, 1962; Morise, Shimomura, Johnson and Winant, 1974)和Douglas Prasher(1951-)(Prasher et al., 1992)工作的基础上,钱永健参与证明单个蛋白质(绿色荧光蛋白, GFP)可以因为结合钙离子后发出荧光(Heim, Prasher and Tsien, 1994;Chalfie et al., 1994)。
已知辣椒里面的分子辣椒素(capsaicin)可以增强痛敏感性、也可以造成热感。David Julius(1955-)于1980年代在Richard Axel实验室做博士后的阶段用表达克隆寻找五羟色胺的受体(Julius et al., 1988)。到旧金山加州大学任教多年后,他继续用表达克隆,其中一个课题为寻找辣椒素的受体,认为找到辣椒素的受体可能有助于理解痛觉的机理。这一研究最后对感觉系统的分子机理有很大影响,且不限于外周感觉系统,虽然对理解痛觉影响相对较小。已知脊髓背根神经节(dorsal root ganglia,DRG)不仅传入多种外周感觉,而且对辣椒素有反应。英国科学家用同位素标记的离子证明辣椒素(capsaicin)可以诱导大鼠背根神经节(dorsal root ganglia, DRG)的神经元产生钙离子内流和钠离子内流、不诱导氯离子外流(Wood et al., 1988)。依据这一特征, Julius带领实验室,用DRG的mRNA制备cDNA文库,然后转染到普通培养细胞(常用的HEK293细胞)。起步估计用了含一万六千多种cDNA的库,不断分群并检测,最后拿到一个cDNA,单独转染到HEK细胞就可以对辣椒素出现钙离子内流的反应(Caterina et al., 1997)。编码的蛋白质当时命名为VR1,它不仅介导对辣椒素的反应,而且介导对热的反应,被加温所激活。
有趣的是,VR1并非独一无二的蛋白质,而是属于一个已经知道蛋白质氨基酸序列的家族:Trp通道。但是,在Julius发现VR1介导对辣椒素和热反应时,Trp通道家族的功能其实不很清楚。1969年,美国印地安纳州的Purdue大学生物系韩裔教授Willam Pak(1932-2023)用果蝇的视网膜电图(electroretinogram,ERG)研究果蝇的视觉、并寻找影响果蝇视觉的突变种(Pak et al., 1969)。同年,英国爱丁堡大学的科学家发现一种突变,根据ERG的变化,他们称突变果蝇为“瞬间感受器电位”(Transient Receptor Potential,Trp),相应突变的基因也就是果蝇的Trp基因(Cosens and Manning, 1969)。1989年,美国加州大学伯克利分校Gerald Rubin(1950-)实验室的博士后Craig Montell(1955-)克隆了果蝇的Trp基因(Montell and Rubin,1989)。他们发现Trp基因编码的蛋白质有多重跨膜区,各由大约19个氨基酸组成的疏水段。因为它的突变影响果蝇视网膜对光反应,所以最容易推测的功能是离子通道。但证明它是离子通道花了相当长的时间。Trp类似的基因后来发现于多种生物,包括人。但不仅果蝇的Trp本身并不感受光,其它的Trp具体起什么作用,如何起作用,也都不清楚。
Julius实验室1997年的发现揭示了其直接功能,由此Trp的研究热火朝天,很多人加入Trp研究的行列,发现更多Trp家族成员,发现更多功能,如Julius实验室2002年用薄荷寻找冷敏感的分子(McKemy et al., 2002),结果发现是Trp家族另一成员,有多个Trp通道,温度变化的方向和范围不同的激活不同的Trp通道。还有科学家发现Trp通道感受压力,等等。
视觉、嗅觉、味觉的第一级感受分子都是GPCR。视觉的第一级是通过生物化学分离纯化最早在19世纪得到视紫红质。嗅觉的第一级也被发现是G蛋白偶联的通路,在发现对嗅觉分子敏感的腺苷酸环化酶(Pace et al., 1985)、嗅觉神经元特异的G蛋白(Jones and Reed,1989)和环核苷酸激活的离子通道(Dhallan et al., 1990)的基础上,美国哥伦比亚大学的Richard Axel(1946-)和他的博士后Linda Buck(1947-)通过多聚酶链反应(PCR)发现了小鼠嗅上皮的数以百计的GPCRs(Buck and Axel,1991),以后证明它们是感受嗅觉的分子。味觉再模仿嗅觉也得到类似发现,但味觉的感受分子只有几个,分别对应不同的味觉(甜、咸、苦、酸、鲜)(Hoon et al., 1999; Chandrashekar et al., 2009)。
确定Trp通道的功能,解决了其他常见感觉(温、部分的压、部分的痛)第一级的分子机理,有较大意义。
最初以为听觉也是用一种Trp通道,后来发现听觉的毛细胞还有其他结构完全不同的压力感受分子,如TMC(Kurima et al., 2002; Vreugde et al., 2002; Jia et al., 2020)。而外周和内脏的压力感受器也有多种,如美国加州的Scripps研究所的Patapoutian实验室发现的Piezo(Coste et al., 2010, 2012)和GPCR(Xu et al., 2018)。貌似简单的压力,却在第一级的感受用了很多结构不同的分子。
14.5 按功能特点寻找基因:重组激活基因的发现
第七章我们讲到,体细胞DNA重组是免疫球蛋白多样性的最重要原因。
那么,发现重组酶就应该是理解其机理的关键。
重组酶发现于当时在MIT的分子生物学家David Baltimore(1938-)的实验室。Baltimore两年完成自己的博士论文,32岁发现反转录酶,37岁与Howard Temin共享诺奖,1986年发现NF-kB,1989年发现重组激活基因(RAG)。RAG基因的发现是一系列实验的结果。
1984年,Baltimore的研究生Susanna Lewis设计了实验,用免疫球蛋白k轻链基因的部分序列重构V-J重组。他们选取了鼠胚Vk和Jk及其附近的DNA序列,装在病毒里面。将这种病毒感染淋巴细胞样的体外培养细胞系PD。他们在序列Vk和Jk之间,装了来自细菌的可以产生对霉酚酸起抵抗性的黄嘌呤-鸟嘌呤磷酸核糖转移酶(xanthine-guanine phosphoribosyl transferase,gpt)。因为预计重组导致其间DNA序列翻转,所以放到病毒的是反向的gpt序列。一旦发生Vk和Jk之间重组,其间的序列翻转,gpt成为正向而可以表达GPT蛋白质,细胞能够抵抗霉酚酸。Lewis等成功地观察到,她们的分子构造,转染入PD细胞系后,经过霉酚酸后得到的细胞株多数都是因出现了Vk和Jk之间DNA重组、gpt序列翻转(Lewis et al.,1984)。
Baltimore实验室的另一位研究生David Schatz用类似Lewis的方法,再构建了一个含B潮霉素抗性基因(hph)的病毒。用两种病毒,他们检验了多种B细胞前体细胞样的细胞系,多数能够重组Vk和Jk之间DNA、翻转gpt或hph抗性基因序列,导致细胞对霉酚酸或B潮霉素有抵抗性。但如果用同样的病毒感染3T3成纤维细胞系,就不能发生Vk和Jk之间DNA重组(Schatz and Baltimore,1988)。Schatz在实验室周会上讲自己工作进展时,以色列来的博士后Yoav Citri(1953-1995)建议想办法激活3T3细胞中的V(D)J重组活性,这一建议影响了后面的研究(Schatz and Baltimore,2004)。
要在3T3细胞发生Vk和Jk之间DNA重组,当时一般的设计应该是把可重组Vk-Jk的细胞(前B细胞)的mRNA做成cDNA文库。文库的大量不同cDNA转染到3T3细胞,后者含有可以检测Vk和Jk之间DNA重组的gpt或hph。在没有转染来自前B细胞cDNA的情况下,3T3细胞会被霉酚酸或B潮霉素杀死。而如果有前B细胞的cDNA导致Vk和Jk之间DNA重组,使得其间的gpt或hph基因成为可以表达的方向,从而有GPT或HPH合成,这样的3T3细胞就能抵抗霉酚酸或B潮霉素。多数3T3细胞都被转染了与重组酶无关的cDNA,这些3T3细胞会被霉酚酸或B潮霉素杀死,剩下可抵抗霉酚酸或B潮霉素的3T3细胞就很可能是表达了重组酶的cDNA从而导致Vk和Jk之间DNA的重组。
因为一种细胞表达很多mRNA从而可以得到很多不同的cDNA,如果是一种cDNA编码重组酶,那么这种方法一般是可行的。但是,如果是多种cDNA编码的蛋白质才能引起Vk和Jk之间DNA重组,那么同时含有两种或多种起作用的cDNA的几率就会很小。Baltimore当时在Whitehead研究所的同事Robert Weinberg(1942-)用分子生物学研究癌症,Weinberg实验室用基因组DNA制备文库。将这种文库转染到3T3细胞时,每个3T3被转染的不会只是单个cDNA,而是一段基因组DNA,可能含相邻几个基因。
Schatz把B淋巴瘤的基因组DNA转染到3T3,基因组DNA接了一种抗性基因(组氨醇脱氢酶),首先用这种抗性基因针对的药物(组氨醇)选择被B淋巴瘤的基因组DNA转染了的3T3细胞。然后用霉酚酸选择发生了V-J重组的3T3细胞。他们从1500个抵抗组氨醇的3T3细胞克隆得到1个抗霉酚酸的3T3细胞株(Schatz and Baltimore,1988)。他们分析发现这一3T3细胞株确实出现了Vk和Jk之间DNA重组,使得其间的gpt表达,而不是其他原因对霉酚酸出现抵抗。但很多人不信,他们附近的实验室认为他们的结果不可靠、发表的是伪迹(Schatz and Baltimore,2004)。
Schatz与研究生Marjorie Oettinger组成两人合作,每天倒班、想方设法克隆重组激活基因(RAG)。他们用特定的寡核苷酸标记基因组的DNA,从出现重组的细胞中通过用于标记的寡核苷酸取得基因组DNA片段,以此克隆了RAG的催化亚基RAG-1(Schatz, Oettinger and Baltimore,1989)。RAG-1基因编码含一千余氨基酸残基的蛋白质,其同源基因存在于有V(D)J重组的动物如人、鼠、兔、羊、马、鸡、蛙。在人和鼠能够进行V(D)J重组的细胞系,RAG-1也有表达。RAG-1表达的细胞和组织与V(D)J重组活性相关:RAG-1表达于鼠的胸腺、骨髓和胚胎,而不在脾脏和脑表达。
在一派大好的形势下,有个异数:含RAG-1基因的18kb DNA,催化V(D)J重组的活性居然与最初全基因组切的片段效率一样,比预计的低100到1000倍。当时他们的估计是也许因为所用的基因组DNA不够长,缺乏某些未知的转录控制元件和34个氨基酸(Schatz, Oettinger and Baltimore,1989)。但后来发现,得到全长的cDNA后,活性也不高(Oettinger et al.,1990)。他们经过几个月的迷惑不解,不断提各种可能。其中一个比较难以置信的可能性是RAG-1旁边碰巧还有一个基因,与它共同起作用(Schatz and Baltimore,2004)。在细菌中,已知相关功能的基因聚集在附近,而动物细胞的基因早已知道没有这样的规律,类似功能的基因在附近一般少见。
她们发现在原初有重组活性的18kb基因组DNA中,RAG-1基因只占其中6.6kb,另有11kb,余下的基因组DNA中还有一个基因。她们进一步的工作证明这个基因可以提高RAG-1重组效率1000倍,因此她们称这一基因为RAG-2(Oettinger et al.,1990)。以后知道,RAG-1独立进化自转座酶Transib,后来又捕获了RAG-2基因进一步增强其活性,之后RAG-1和RAG-2的序列和功能变化成为专门用于Ig基因重组的酶(Carmona and Schatz,2017)。
14.6 基因敲除或敲低
降低或去除特定基因,观察后果,是研究基因功能的重要方法。而这种方法如果效率足够高、能够同时用于多个基因,可能成为普遍的筛选方法。
降低或去除基因的方法,经过很多科学家的努力和漫长的时间,最后有了非常好的技术,并从针对一个基因演变成为可以用于筛选。
分子生物学技术诞生的初期,MGH的Paul Zamecnik实验室就探索了用“反义寡核苷酸”抑制基因表达(Zamecnik and Stephenson, 1978)。设计与靶基因转录的mRNA可以互补的反义寡核苷酸,它进入细胞后与mRNA结合,从而抑制基因功能。最初以为是反义寡核苷酸直接抑制mRNA的功能,后来意识到细胞有酶降解这种双链。所用的寡核苷酸,初以RNA(“反义RNA”)为主,后来有其他修饰的寡核苷酸。曾经有一段时间效率很低,多年工艺改造后,效率得到提高。
在细菌里面,按照DNA序列进行同源重组,很容易敲除目的基因。但在其他生物,同源重组的比例很低。美国犹他大学的Mario Cappechi(1937-)先证明哺乳动物的细胞也有同源重组,只是效率很低。然后他带领实验室发明可以筛选同源重组的正反选择方法,从而可以用小鼠胚胎干细胞(ES)进行同源重组,然后用正反选择方法选出发生了重组的ES细胞,将ES细胞植入小鼠子宫,发育出来的小鼠就缺乏目的基因,成为第一个哺乳动物非常有效的“基因敲除”方法(Thomas and Capecchi, 1987;Mansour, Thomas and Capecchi, 1988)。这一方法用于一个一个敲除基因很有效,但难以用于同时筛选很多基因。
RNA干扰(RNAi)现象,是Andrew Fire(1959-)偶尔发现的。他的实验室用反义RNA研究线虫特定基因功能的时候,用正链RNA作为对照的时候,有时居然也有与反义RNA一样的“抑制作用” (Fire et al., 1998)。他们注意到1995年另外一个实验室也观察到这样的结果,并如实报道了,但没有作为科学问题进一步研究(Guo and Kemphues, 1995)。Fire等的研究发现这不是针对少数几个RNA的现象,在线虫是普遍现象。以后吸引很多人研究RNAi,搞清楚其特异的分子机理,而且知道在其他物种怎么可以高效地起作用。在线虫,甚至可以通过食物喂寡核苷酸,可以被摄取,而且到细胞里面起作用,所以可以用于筛选。但在大多数其他生物,包括哺乳动物的细胞,难以用于筛选。
“锌指核酸酶”(zinc finger nucleases, ZFN)是美国霍普金斯大学印度裔科学家Srinivasan Chandrasegaran专门发明的技术,将核酸内切酶的融合到结合特异DNA序列的锌指区域,让锌指把核酸内切酶带到特定DNA,进行切割,造成基因剔除(Kim, Cha and Chandrasegaran,1996)。这一方法进一步发展后可以用于动植物(Bibikova et al., 2002),但难以用于筛选。
特殊生物可以含有特别的分子。地热环境中找到的生物含高温稳定的DNA多聚酶,可以被人们用于PCR。黄单胞菌(Xanthomonas)中有转录蛋白“TALE” (transcription activator-like effectors),而其识别DNA序列的方式非常有趣:是由TALE蛋白中氨基酸序列所决定(Moscou and Bogdanove, 2009; Boch et al., 2009)。确定了其特定区段的氨基酸序列,就可以结合到特定序列的DNA。如果把它再融合到特定蛋白质(例如核酸内切酶,得到TALEN)就可以切断特定的DNA序列,起到基因剔除的作用。当然,也可以融合其他功能的蛋白质,而起其他作用。这一方法非常特异,但不易用于筛选。
14.7 分子生物学筛选:CRISPRi
CRISPR-CAS9系统,提供了迄今最有效的基因编辑方法。
科学家最初在微生物中发现CRISPR:clustered regularly interspaced short palindromic repeats, 后来才意识到这些重复序列可以与DNA进行特异的碱基配对的结合,而与CRISPR相关(Cas)的Cas9是核酸内切酶,它们原本在细菌中起免疫作用。法国科学家Emmanuelle Charpentier(1968-)和美国科学家Jennifer Doudna(1964-)合作发明作为通用于基因编辑的CRISPR-Cas9体系(Jinek et al., 2012),Cas9在sgRNA(single guide RNA)引导下,切割被sgRNA结合的DNA序列。CRISPR-Cas9不仅在许许多多中生物中有效,而且很多科学家在不断改进其编辑质量、推广其使用范围。
对本章重要的是,它可以衍生出筛选的方法。这里介绍2014年几个实验室同时发明的CRISPRi。MIT的Eric Lander(Wang et al., 2014)和张峰两个实验室(Shalem et al., 2014)、英国Sanger研究所的遊佐宏介实验室(Koike-Yusa et al., 2014)和北京大学的魏文胜实验室(Zhou et al., 2014)发明了用CRISPR-Cas9筛选功能基因的方法。简而言之,在用于筛选的细胞中,稳定表达Cas9。针对被筛选的基因(例如人类基因组全部编码蛋白质的基因),每一个基因设计三个sgRNA,装入病毒载体(例如lentiviral vector)。表达sgRNA的载体,可以同时表达抗生素抵抗基因。可以通过直接的功能进行筛选。例如,某分子造成某种细胞死亡。可以将CRISPRi体系用于筛选对该分子诱导死亡的机理。sgRNA的病毒感染这种细胞细胞后,出现少数细胞不死了。把这些不死的细胞生长繁殖,收集它们里面所富集的sgRNA。用含这些sgRNA的病毒,再进行两轮富集。那么就可以得到抑制该分子杀死该细胞的sgRNA。通过把具体的sgRNA单独用于该细胞,如果验证确实能够抑制该分子杀死该细胞,那么sgRNA所对应的基因就是参与该分子杀死该细胞的机理。
CRISPRi的细节,可以有多种衍生,包括sgRNA文库的大小,细胞功能的检测。迄今检测死亡,逆转死亡,为最佳。但不能引起死亡的,可以通过其他方式转为死亡检测。也可以用成像检测基因表达的方法。除了抑制,也可以做激活的筛选,例如CRISPRa(Gilbert et al., 2013; Mali et al., 2013; Perez-Pinera et al., 2013; Maeder et al., 2013)。
在培养细胞系之外,能否在组织、器官甚至动物体内做筛选,估计也是技术发明者们努力的目标。
参考文献
Bernardi G, Chromatography of nucleic acids on hydroxyapatite. Nature 206:779-183。
Benedict WF, Banerjee A, Gardner A, Jones PA(1977). Induction of morphological transformation in mouse C3H/10T½ clone 8 cells and chromosomal damage in hamster A(T1)C1-3 cells by cancer chemotherapeutic agents. Cancer Research 37:2202-2208.
Bibikova M, Golic M, Golic KG and Carroll D (2002). Targeted chromosomal cleavage and mutagenesis inDrosophila using zinc-finger nucleases. Genetics 161:1169-1175.
Boch J, Scholze H, Schornack S, Landgraf A, Hahn S, Kay S, Lahaye T, Nickstadt A and Bonas J (2009). Breaking the code of DNA binding specificity of TAL-type III effectors. Science 326:1509-1512.
Buck L and Axel R (1991). A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell 65:175-187.
Carmona LM and Schatz DG (2017). New insights into the evolutionary origins of the recombination-activating gene proteins and V(D)J recombination. Federation of European Biochemical Societies Journal 284:1590-1605.
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD and Julius D (1997). The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 389:816-24.
Chandrashekar JC, Yarmolinsky D, von Buchholtz L, Oka Y, Sly W, Ryba NJP and Zuker CS (2009). The taste of carbonation. Science 326:443-445.
Constantinides PG, Jones PA and Gevers W (1977). Functional striated muscle cells from non-myoblast precursors following 5-azacytidine treatment. Nature 267:364-366.
Cosens DJ and Manning A (1969). Abnormal electroretinogram from aDrosophila mutant. Nature 224: 285-287.
Coste B,Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, Dubin AE and Patapoutin A (2010). Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels. Science 330:55-60.
Coste B, Xiao B, Santos JS, Syeda R, Grandl J, Spencer KS, Kim SE, Schmidt M, Mathur J, Dubin AE, Nontal M and Patapoutian A (2012). Piezo proteins are pore-forming subunits of mechanically activated channels. Nature 483:176-181.
DavisRL, Weintraub H and Lassar AB (1987). Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell 51:987-1000.
Dhallan RS, Yao KW, Schrader KA and Reed RR (1990). Primary structure and functional expression of a cyclic nucleotide-activated channel from olfactory neurons. Nature 347:184-187.
Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE and Mello CC (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391:806-811.
Gerhart J, Danilchik M, Doniach T, Roberts S, Rowning B, Stewart R (1989). Intracellular signaling centers: their establishment and modes of action. Development 107:37-51.
Gilbert LA, Larson MH, Morsut L, Liu Z, Brar, Torres, Stern-Ginossar N, Brandman, Whitehead EH, Doudna JA, Lim WA, Weissman JS and Qi LS (2013). CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell 154:442-451.
Gimlich RL, Gerhart JC (1984). Early cellular interactions promote embryonic axis formation in Xenopus laevis. Developmental Biology 104:117-130.
Guo S and Kemphues K (1995).par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed. Cell 81:611-620.
Gurdon JB,Lane CD, Woodland HR, Marbaix G (1971). Use of frog eggs and oocytes for the study of messenger RNA and its translation in living cells. Nature 233:177-182.
Hediger MA, Coady MJ, Ikeda TS and Wright EM (1987). Expression cloning and cDNA sequencing of the Na+/glucose co-transporter. Nature 330:379-381.
Hoon MA, Adler E, Lindemeier J, Battey JF, Ryba NJP and Zuker CS(1999). Putative mammalian taste receptors a class of taste-specific GPCRs with distinct topographic selectivity. Cell 96:541-551.
Jia Y, Zhao Y, Kusakizako T, Wang Y, Pan C, Zhang Y, Nureki O, Hattori M and Yan Z (2020). TMC1 and TMC2 proteins are pore-forming subunits of mechanosensitive ion channels. Neuron 105:310-321.
Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA and Charpentier E (2012). A programmable dual-RNA-guided DNA endoclease in adaptive bacterial immunity. Science 337:816-821.
Jones DT and Reed RR (1989). Golf: an olfactory neuron specific-G protein involved in odorant signal transduction. Science 244:790-795.
Jordt SE and Julius D (2002). Molecular basis for species-specific sensitivity to “hot” chili peppers. Cell 108:421-30.
Julius D, MacDermott AB, Axel R and Jessell TM (1988). Molecular characterization of a functional cDNA encoding the serotonin 1c receptor.Science 241:558-564.
Kao KR,Masui Y and Elinson RP (1986). Lithium-induced respecification of pattern in Xenopus laevis embryos. Nature 322:371-373.
Kim Y-G, Cha J and Chandrasegaran S (1996). Hybrid restriction enzymes: zinc finger fusions toFokI cleavage domain. Proceedings of the National Academy of Sciences USA 93:1156-1160.
Koike-Yusa H, Li Y, Tan EP, Velasco-Herrera MC and Yusa K (2014). Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library. Nature Biotechnology 32:267-273.
Kurima K, Peters LM, Yang Y, Riazuddin S, Ahmed ZM, Naz S, Arnaud D, Drury S, Mo J, Makishima T et al. (2002). Dominant and recessive deafness caused by mutations of a novel gene, TMC1, required for cochlear hair-cell function. Nature Genetics 30:277-284.
Lassar AB, Paterson BM and Weintraub H (1986). Transfection of a DNA locus that mediates the conversion of 10T1/2 fibroblasts to myoblasts. Cell 47:649-656.
Lassar AB, Buskin JN, Lockshon D, Davis RL, Apone S, Hauschka SD and Weintraub H (1989).MyoD is a sequence-specific DNA binding protein requiring a region of myc homology to bind to the muscle creatinine kinase enhancer. Cell 58:823-831.
Lewis S, Gifford A and Baltimore D (1984. Joining of Vk to Jk gene segments in a retroviral vector introduced into lymphoid cells. Nature 308:425-428.
Lübbert H, Hoffman BJ, Snutch TP, van Dyke T, Levine AJ, Hartig PR, Lester HA and Davidson N (1987). cDNA cloning of a serotonin 5-HT1Creceptor by electrophysiological assays of mRNA-injected Xenopus oocytes. Proceedings of the National Academy of Sciences USA 84:4332-4336.
Maeder ML,Linder SJ, Cascio VM, Fu Y, Ho QH and Joung JK (2013). CRISPR RNA-guided activation of endogenous human genes. Nature Methods 10:977-979.
Mali P,Aach J, Stranges PB, Esvelt KM, Moosburner M, Kosuri S, Yang L and Church GM (2013). CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering. Nature Biotechnology 31:833-838.
Mansour SL, Thomas KR and Capecchi MR (1988). Disruption of the proto-oncogeneint-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature 336:348-352.
Masu Y, Nakayama K, Tamaki H, Harada Y, Kuno M and Nakanishi S (1987). cDNA cloning of bovine substance-K receptor through oocyte expression system. Nature 329:836-838.
McKemy DD, Neuhausser WM and Julius D (2002). Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature 416:52-58.
Montell C and Rubin GM (1989). Molecular characterization of theDrosophila trp locus: a putative integral membrane protein required for phototransduction. Neuron 2:1313-1323.
Moriyoshi K, Masu M, Ishii T, Shigemoto R, Mizuno N and Nakanishi S (1991). Molecular cloning and characterization of the rat NMDA receptor. Nature 354:31-37.
Moscou MJ and Bogdanove AJ (2009). A simple cipher governs DNA recognition by TAL effectors. Science 326:1501.
Mowry KL (2020). Using the Xenopus oocyte toolbox. Cold Spring Harbour Protocol doi:10:1101/pdb.top095844.
Nieuwkoop PD (1969). The formation of the mesoderm in urodelean amphibians. I. Induction by the endoderm. Wilhelm Roux’ Archieve of Developmental Biology 162:341-373
Nieuwkoop PD, Ubbels GA (1972). The formation of the mesoderm in urodelean amphibians. IV. Qualitative evidence for the purely “ectodermal” origin of the entire mesoderm and of the pharyngeal endoderm. Wilhelm Roux’ Archieve of Developmental Biology 169:185-199.
Pace U, Hanski E, Salomon Y and Lancet D (1985). Odorant-sensitive adenylate cyclase may mediate olfactory reception. Nature 316:255-258.
Pak WL, Grossfield J and White NV (1969). Nonphototactic mutants in a study of vision ofDrosophila. Nature 222:351-354.
Perez-Pinera P,Kocak DD, Vockley CM, Adler AF, Kabadi AM, Polstein LR, Thakore PI, Glass KA, Ousterout DG, Leong KW, Guilak F, Crawford GE, Reddy TE and Gersbach CA (2013). RNA-guided gene activation by CRISPR-Cas9-based transcription factors. Nature Methods 10:973-976.
Oettinger MA, Schatz DG, Gorka C and Baltimore D (1990). RAG-1 and RAG-2, adjacent genes that synergistically activate V(D)J recombination. Science 248:1517-1523.
Rebagliati MR, Weeks DL, Harvey RP, Melton DA (1985). Identification and cloning of localized maternal RNAs from Xenopus eggs. Cell 42:769-777.
Sasai Y, Lu B, Steinbeisser H, Geissert D, Gont LK and De Robertis EM (1994) Xenopus chordin: a novel dorsalizing factor activated by organizer-specific homeobox genes. Cell 79:779-790.
Schatz DG and Baltimore D (1988). Stable expression of immunoglobulin gene V(D)J recombinase activity by gene transfer into 3T3 fibroblasts. Cell 53:107-115.
Schatz DG, Oettinger MA and Baltimore D (1989). The V(D)J recombination activating gene, RAG1. Cell 59:1035-1048.
Schatz DG and Baltimore D (2004). Uncovering the V(D)J recombinease. Cell S116:S103-S106.
Shalem O, Sanjana NE, Hartenian E, Shi X, Scott DA, Mikkelson T, Heckl D, Ebert BL, Root DE, Doench JG and Zhang F (2014). Genome-scale CRISPR-Cas9 knockout screening in human cells. Science 343:84-87.
Smith WC and Harland RM (1991). Injected Xwnt-8 RNA acts early in Xenopus embryos to promote formation of a vegetal dorsalizing center. Cell 67:753-765.
Smith WC and Harland RM (1992). Expression cloning of noggin, a new dorsalizing factor localized to the Spemann organizer in Xenopus embryos. Cell 70:8129840.
Sumikawa K, Houghton M, Emtage JS, Richards BM and Barnard EA (1981). Active multi-subunit ACh receptor assembled by translation of heterologous mRNA in Xenopus oocytes. Nature 292:862-864.
Taylor S and Jones PA (1979). Multiple new phenotypes induced in 10T1/2 and 3T3 cells treated with 5-azacytidine. Cell 17:771-779.
Thomas KR and Capecchi MR (1987). Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells. Cell 51:503-512.
Vreugde S, Erven A, Kros CJ, Marcotti W, Fuchs H, Kurima K, Wilcox ER, Friedman TB, Griffith AJ, Balling R et al. (2002). Beethoven, a mouse model for dominant, progressive hearing loss DFNA36. Nature Genetics 30:257-258.
Wang T, Wei JJ, Sabatini DM and Lander ES (2014). Genetic screens in human cells using the CRISPR-Cas9 system. Science 343:80-84.
Weeks DL and Melton DA (1987). A maternal mRNA localized to the vegetal hemisphere in Xenopus eggs codes for a growth factor related to TGF-b. Cell 51:861-777.
Wood JN, Winter J, James IF, Rang HP, Yeats J and Bevan S (1988). Capsaicin-induced ion fluxes in dorsal root ganglion cells in culture. Journal of Neuroscience 8:3208-3220.
Xu J, Mathur J, Vessières E, Hammack S, Nonomura K, Favre J, Grimaud L, Petrus M, Francisco A, Li J, Lee V, Xiang F-L, Mainquist JK, Cahalan SM, Orth AP, Walker JR, Ma S, Lukacs V, Bordone L, Bandell M, Laffitte B, Xu Y, Chien S, Henrion D and Patapoutian A (2018). GPR68 senses flo and is essential for vascular physiology. Cell 173:762-775.
Zamecnik PC and Stephenson ML (1978). Inhibition of Rous sarcoma virus replication and cell transformation by a spe cific oligodeoxynucleotide. Proceedings of the National Academy of Sciences USA 75:280-284.
Zhou Y, Zhu S, Cai C, Yuan P, Li C, Huang Y and Wei W (2014). High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature 509:487-491.
阅读
Schatz DG, Oettinger MA and Baltimore D (1989). The V(D)J recombination activating gene, RAG1. Cell 59:1035-1048.
Koike-Yusa H, Li Y, Tan EP, Velasco-Herrera MC and Yusa K (2014). Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library. Nature Biotechnology 32:267-273.
15A 美妙的荧光分子 与 好奇的生化学家
做出应获诺贝尔奖工作的科学家,几十年默默无闻;
被广泛应用的分子,很少人知其发现者;
原始论文鲜为人知,后继论文倒很热门;
曾失明的人,发现了美丽的发光蛋白;
低调的父亲,出了高调的儿子。
这里简介一项生物化学研究,讲一个科学家的故事,还讨论一个问题:是否活着的科学家中还有因好奇而做科学研究?
本文不是预测诺贝尔奖,而是介绍值得获奖的工作。我不介绍可能获奖、但其工作不值得获奖者。相反,本文的主人公可能被埋没得不到奖,但他的工作很值得介绍。
15A1 生物发光和荧光蛋白
现在研究生物的人,几乎都知道绿色荧光蛋白(GFP),但常常不知或搞错其发现者。毫无争议的发现者是日裔美国科学家下村修(Osamu Shimomura,下村脩)和已故美国科学家约翰森(Frank H. Johnson)。他们1961到1974年发现两种发光的蛋白质:水母素(aequorin)和GFP。
生物发光现象,下村修和约翰森之前就有人研究。萤火虫发荧光,是由荧光酶(luciferase)作为酶催化底物分子荧光素(luciferin),有化学反应如氧化,以后产生荧光。而发现蛋白质本身发光,无需底物,起源于下村修和约翰森的研究。
下村修和约翰森用过几种实验动物,和本故事相关的是学名为Aequorea victoria的水母。1962年,下村修和约翰森等在《细胞和比较生理学杂志》上报道,他们分离纯化了水母中发光蛋白水母素。据说下村修用水母提取发光蛋白时,有天下班要回家了,他把产物倒进水池里,临出门前关灯后,回头看一眼水池,结果见水池闪闪发光。因为养鱼缸的水也流到同一水池,他怀疑是鱼缸排出的成分影响水母素,不久他就确定钙离子增强水母素发光。1963年,他们在《科学》杂志报道钙和水母素发光的关系。1967年Ridgway和Ashley提出检测钙的新方法:用水母素。钙离子是生物体内的重要信号分子,水母素成为第一个有空间分辨能力的钙检测方法,是目前仍用的方法之一。
1955年Davenport和Nicol发现水母能发绿光,但不知其所以然。1962年下村修和约翰森纯化水母素的文章中,有个注脚,说还发现了另一种蛋白,它在阳光下呈绿色、钨丝灯下呈黄色、紫外光下发强烈绿色。其后他们仔细研究了其发光特性。1974年,他们得到了这个蛋白,当时称绿色蛋白、以后称绿色荧光蛋白(GFP)。Morin和Hastings提出水母素和GFP之间可以发生能量转移。水母素在钙刺激下发光,其能量可转移到GFP,刺激GFP发光。这是在生物中的发现物理化学中已知的荧光共振能量转移(FRET)。
下村修本人对GFP的应用前景不敏感,也未意识到应用的重要性。他离开普林斯顿到Woods Hole海洋研究所后,他的同事普瑞舍(Douglas Prasher)非常感兴趣用荧光蛋白做生物示踪分子。1985年普瑞舍和日裔科学家Satoshi Inouye分别根据蛋白质序列拿到了水母素的基因(生物学上准确地说是cDNA)。1992年,普瑞舍又拿到GFP的基因。有了cDNA,一般生物学研究者就很容易应用,比用蛋白质方便多了。
普瑞舍1992年发表GFP基因的文章后,离开科学界。原因是他申请美国国家科学基金时,评审者说没有蛋白质发光的先例,就是他找到了这种蛋白,也无价值。他离开学术界去麻省空军国民卫队基地,到农业部动植物服务部工作。当时他如果花几美元,就可以做一个一般研究生都能做,但非常漂亮的工作:将来自水母的GFP基因放到其他生物体内(如细菌),看到荧光,可以很强烈地提示GFP本身可以发光,无需其他底物、或者辅助分子,也表明可以广泛用GFP。
将GFP表达到其他生物体这项工作,1994年由两个实验室独立进行:美国哥伦比亚大学做线虫的Marty Chalfie实验室,和加州大学圣迭哥分校、Scripps海洋研究所的两位日裔科学家Inouye和Tsuji。
水母素和GFP都有重要的应用。但水母素仍是荧光酶的一种,它需底物荧光素。而GFP是蛋白质本身发光,原理上不同。
Chalfie的文章立即引起轰动,很多生物学研究者纷纷将GFP引入自己的研究系统。当时好些并无原创性的文章发表在《自然》、《科学》等刊物,证明哪里表达GFP,哪里就有绿光,这些后续文章不过是跟风。
1994年,华裔美国科学家钱永健(Roger Y Tsien)开始改造GFP,有多项发现。世界上目前使用的荧光蛋白大多是钱永健实验室改造后的变种,有的荧光更强,有的呈黄色、蓝色,有的可激活、可变色。其后,一些人热衷到一些不常用做研究样本的生物中寻找有颜色的蛋白,不过真发现的有用东西并不很多,成功的例子有俄国科学院生物有机化学研究所Sergey A. Lukyanov实验室从珊瑚里发现的其他荧光蛋白,包括红色荧光蛋白。
综观整个过程,从1961年到1974年,下村修和约翰森的研究遥遥领先,但很少人注意。单纯从技术上,其他生化学家也可以得到水母素和GFP,但需要有想法或兴趣。在1974年以后,特别是八十年代后,很多后续工作显而易见,一般研究生可以做。其中例外是钱永健实验室发现变种出现新颜色,这一发现出乎意料。
15A2 GFP之美丽和妙用
GFP及其衍生物(各种荧光蛋白),绚丽多彩,非常漂亮。
有些荧光蛋白当浓度足够高时,在日光下可以看到颜色。所以实验室产生了人为可控制颜色的鱼、老鼠。
荧光蛋白广泛应用于生物学研究。可以通过常规的基因操纵手段,将荧光蛋白用来标记其他目标蛋白,这样可以观察、跟踪目标蛋白的时间、空间变化。提供了以前不能达到的时间和空间分辨率,而且可以在活细胞、甚至活体动物中观察到一些分子。荧光蛋白技术也使得人们可以研究某些分子的活性,而不仅仅是其存在与否。
对于有些研究来说,荧光蛋白的作用可以形容为“起死回生”:原来有些方法,需要把生物变成死物才能研究一些现象和过程,而荧光蛋白为主要支柱之一的现代成像技术,使科学家在活的细胞中观察和研究这些过程,使一部分“死物学”变成“生物学”。
15A3 为了好奇
下村修1928年生于京都,长于长崎。1945年他16岁时,原子弹在他故乡爆炸,他曾失明数周。1951年,他毕业于长崎医科大学药学专门部,1960年获名古屋大学有机化学博士。1960年他到美国普林斯顿大学约翰森实验室做博士后,63年至65年回日本名古屋大学任副教授,65年回普林斯顿继续在约翰森实验室,直到1980年。估计是约翰森退休后下村修不能待在普林斯顿了,所以1980至2001年他到麻省Woods Hole海洋生物学研究所工作、并有波士顿大学兼职教授之软差。
下村修1961年33岁做出重要发现(1962年发表),到1974年46岁时,全部关键实验完成。但到80岁的今年,他几乎是默默无闻。他多年没有实验室,在约翰森实验室做了近20年博士后,不是为了功。他也没有当选美国科学院院士,不是为了名。GFP后来带来了相当的收益,但下村修没得,也不是为了利。
下村修加入生物发光研究是1955年在日本做研究生时,导师让他到另外一个实验室去开阔眼界,而那个实验室的导师介绍他做荧光素。1959年导师逝于癌症,1960年他到约翰森实验室。约翰森给他看水母发光,要他做,可是第一次演示根本没有发光。但下村修被约翰森感染了,决定做这个课题。1961年约翰森开了七天的车、每天12小时,带下村修横跨美国到西海岸华盛顿州的“星期五港”实验室,那里当时盛产水母,有很多原料,他们在1961年夏做出主要发现。
下村修开始做研究时不知其重要性,只是对生物发光好奇。发光的生物学意义,至今尚不清楚;而发光蛋白应用的重要性,下村修不仅当时不知道,而且以后相当时间不清楚。水母素应用于检测钙,是1967年由Ridgway和Ashley提出。最初下村修和约翰森只为提取水母素,而GFP是副产物。现在,这个副产物的用途比原来的正产物还大。GFP作为示踪蛋白是普瑞舍极力鼓吹。广泛应用在1994年以后。从1974年获得GFP到1994年,下村修并未大力推动GFP的应用。
下村修乐于做这项工作,只需很基本的条件。2001年退休后,他继续做研究,把家里的地下室作为“光蛋白实验室”,2008年80岁的他,还用家庭地址发表文章。
15A4 科学界并不公平
下村修有非常重要的科学贡献。但是科学界多半不知道他,只知道后续工作,社会的认可就更少。
在普林斯顿,他二十年没有独立实验室,在别人领导下工作。到Woods Hole后,是很小的几人小组。他80岁了,也没有当选哪里的院士。最近几年开始获些不知名的奖。非常热衷于国民获诺贝尔奖的日本,到近年才有少数专家知道下村修。
下村修虽然做了非常原创性的工作,很多人用他发现的GFP,有些生物学杂志每期都有文章用GFP,有些生物杂志每期20%的文章用了GFP,但绝大多数人并不知道发现者是下村修。下村修和约翰森1962年发现水母素的文章迄今被377次引用,1974年纯化GFP的文章被引用169次,Chalfie等1994年《科学》文章被引用3349次,Inouye 和Tsuji的1994年文章被引用256次。说明大多数科学工作者并不知道所用的东西怎么来的。简单引用率更不能代替对领域的真正了解。
不仅下村修没有被广泛认可,其他一些人也遭忽略。1990年,他的合作者约翰森82岁去世时,《纽约时报》的悼文没有提GFP。普瑞舍拿到GFP基因但缺经费。Chalfie文章引用率高但专利搞砸了没多少收益。
这个领域,最重要的工作显然是下村修和约翰森做的。钱永健在两个方面做出了重要的贡献,如果钱与下村修合得奖也很合理。第三重要的是普瑞舍。他承前启后,有助于推广应用下村修的发现。
15A6钱永健的贡献
钱永健是取得重要成就的科学家。他在成像技术中,有两项重要工作都与下村修有一定关系。
一项是钙染料。1980年钱永健发明检测钙离子浓度的染料分子,1981年改进将染料引入细胞的方法,以后发明更多、更好的染料,被广泛应用。检测钙的方法有三种:选择性电极、水母素、钙染料。在钱永健的钙染料没有出现以前,具有空间检测能力的只有水母素,但当时水母素需要注射到细胞内,应用不方便,而钱永健的染料可以通透到细胞里面去。水母素和钙染料各有优缺点,目前用染料的人多。钱永健还发明了多种染料用于研究其他分子。
钱永健的第二项工作是GFP。1994年起,钱永健开始研究GFP,改进GFP的发光强度,发光颜色(发明变种,多种不同颜色),发明更多应用方法,阐明发光原理。世界上应用的FP,多半是他发明的变种。他的专利有很多人用,有公司销售。
钱永健的工作,从八十年代一开始就引人瞩目。他可能有一段时间是世界上被邀请给学术报告最多的科学家,因为化学和生物界都爱听他的报告,既有技术应用、也有一些很有趣的现象。很多人多年认为钱永健会得诺贝尔奖,可以是化学、也可以是生理奖。值得指出,钱永健非常肯定下村修的工作,钱较早公开介绍下村修的发现。
钱永健是钱学森的堂侄。他家多科学家和工程师。他中学时获得过西屋天才奖第一名,大学在哈佛念化学和物理,20岁毕业,后获英国剑桥大学生理学博士。他哥哥钱永佑(Richard W Tsien)是神经生物学家,曾任Stanford大学生理系主任。两兄弟分别获Rhodes和Marshall学者奖,到英国留学,九十年代双双成为美国科学院院士。钱学森回国后,国内教育体系在他的子女应该上大学时受到极大破坏,使钱的子女钱永刚、钱永真没有得到他们堂兄弟那样的发展环境。钱永刚出生于1948年,文革后才念大学。但愿钱永健在钱学森先生在世的时候获奖,告慰他们全家。
15A7 科学界还会有下村修吗?
这个问题可以分几个方面讨论。
当然可以问是否现代科学工作者,比较功利,能否象他那样抱着一个不知道重要性的东西,不追求资源、不追求认可,持之以恒,自得其乐。
然后也可以问,如果碰到这样的人,谁会支持他?下村修和钱永健相差很大。钱永健是人们很快就知道有聪明资质的天才,支持他的人很多,他的工作出来马上为人所知。下村修基本是反例。没人认为他是天才,他不知道自己工作的重要性,别人也不容易在早期判断他的工作。普林斯顿就没有重视他,否则不会在约翰森退休后,让他走。实际上,当时的校长不仅不重视他,也不重视生物,当时一批普林斯顿的生物教授因此跑到旧金山加州大学。斯坦福和哈佛很会靠自己的名声和经费实力招已经做出了可以得奖工作的人,但没有发现下村修。
只有少数人会欣赏下村修,支持他做些事。如果要委员会投票表决是否支持他,大概多数委员会难以让他过关。但在科学界,需要有些人、有些机构、有些时候敢于承担风险,支持少数下村修这样的科学家,做些开始看来稀奇古怪、不着边际的工作。成本其实相当低,主要是支持者不怕其他人的批评。其中多数这种人最后没什么结果,但是只要很少一些支持对了,对科学界的作用可以很大。
对于学生来说,赶热门比较容易,但如果注意力不被大流所驱赶,而在如1970年GFP研究状态时加入这种领域,其实是很安全的重要课题,那时已经知道有绿色蛋白,主要是提纯。当然,能做1961年的工作更好,不过那要求就高很多。
年逾80的下村修,无疑应该获诺贝尔奖。但他是否能得到,却有较大疑问。首先诺贝尔奖委员会出错频率不低,近年也出过好几次。其次,诺贝尔化学奖委员会有时横炮打到生物里,或没搞懂全貌、或只从化学出发,把奖发给一个领域的某个人,而忽略了领域里其他人,甚至更重要的人。一类工作被奖后,其他奖的委员会一般不愿再给同类工作发奖,这样造成一个领域最重要的人没得奖,而其他人得奖。这种现象,在下村修身上发生的可能性不小。过去十年,发过好几个与GFP相关的奖,都没有下村修。只有很少几个不出名的奖近年给下村修。他是否能得诺贝尔奖,反映的不是他的水平,而是诺贝尔奖委员会的水平。化学和生理两个委员会,是否能比平时水平高一点,还得拭目以待。人的评判无绝对客观,诺贝尔奖委员会也不例外。
下村修的儿子下村努(Tsutomu Shimomura)是下村修1964年回日本期间出生于名古屋。后随父母回美国,长于普林斯顿,上普林斯顿高中。在加州理工学院念大学时,跟过Richard Feynman。曾任职于加州大学圣迭戈分校的物理系和圣迭戈超级计算中心。下村努90年代协助联邦调查局抓住了一个有名的黑客,让那人坐了牢。1995年,他和记者以此为基础合写一本书Takedown(中文“骇客追缉令” ),书被改编成电影。传说他小时候有逆反心理,后来也可能是黑客,在国会作证时,有联邦调查局探员在身旁,他也黑国会的通讯系统。
15A8 对科学的幻灭和对科学家的悲观失望
以前,一些崇拜科学的人,常把科学家看得比实际更伟大。而得了诺贝尔奖的科学家,也有隐去实情,在得奖后大谈对科学的热爱, 刻意淡化自己对获奖的重视。
现在,做科学研究的人很多,认识科学工作者的人更多。人们发现科学界很多人并不崇高。原来一些得奖的人不仅热衷于获得认可,而且为了得奖去做很多学术政治,有的不断和评选委员会拉关系,有的到评奖机构蹲点“合作研究”,有的贬低其他人工作。还有些科学工作者做研究纯粹为了利益,对学术不感兴趣,甚至造假。诸如此类,不一而足。
一些水平相当于低年级研究生的人,对科学研究和科学家群体非常悲观,自认为看破科学界的红尘,愤世嫉俗,走向反面,认定为好奇而做科学的人早已灭绝,断言已经没有纯粹为科学而科学的科学家。
有些科学工作者一辈子看不见科学的美,看不到科学家追求美的品味和探索真理的高尚,这不仅影响他们自己的科学研究、动力、动机,而且描黑整个科学界,甚至成为科学界的不良分子。
如果一般将科学研究的动力归为三类:好奇、敬业和求胜。为了勉励青年学子,既说明确实很多科学家做科学的动力比较通俗,但也有科学家是好奇驱动。下村修的故事,有助于年轻人明了每十年中生命科学都有几项非常重要的、大家公认的发现和发明,从愤世嫉俗中觉悟过来,潜心寻求好的研究方向,自强不息。
参考文献
Shimomura O, Johnson FH and Saiga Y (1962). Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. Journal of Cellullar and Comparative Physiology 59:223-239.
Shimomura O, Johnson FH and Saiga Y (1963). Microdetermination of calcium by aequorin luminescence. Science140:1339-1340.
Morise H, Shimomura O, Johnson FH and Winant J (1974).Intermolecular energy transfer in the bioluminescent system of Aequorea. Biochemistry 13:2656–62.
Prasher D, McCann RO and Cormier MJ (1985). Cloning and expression of the cDNA coding for aequorin, a bioluminescent calcium-activated protein. Biochemical and Biophysical Research Communication 126:1259–1268.
Inouye S, Noguchi M, Sakaki Y, Takagi Y, Miyata T, Iwanaga S, Miyata T and Tsuji, FI1985Cloning and sequence analysis of cDNA for the luminescent protein aequorin. Proceedings of the National Academy of Sciences USA8231543158
Prasher DC, Eckenrode VK, Ward WW, Prendergast FG, Cormier MJ. (1992). Primary structure of the Aequorea victoria green-fluorescent protein. Gene 111:229-33.
Chalfie M, Tu Y, Euskirchen G, Ward WW and Prasher DC (1994). Green fluorescent protein as a marker for gene expression. Science 263:802-805.
Inouye S and Tsuji FI (1994)Aequorea green fluorescent protein. Expression of the gene and fluorescence characteristics of the recombinant protein. FEBS Lett. 341: 277– 80.
Heim R, Prasher DC and Tsien RY (1994). Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proceedings of the National Academy of Sciences USA 91:12501-12504.
Matz MV, Fradkov AF, Labas YA, Savitsky AP, Zaraisky AG, Markelov ML and Lukyanov SA1999Fluorescent proteins from nonbioluminescent anthozoa species. Nature Biotechnol17969973.
Tsien RY (1980). New calcium indicators and buffers with high selectivity against magnesium and protons: design, synthesis, and properties of prototype structures. Biochemistry 19:2396-2404.
Tsien RY (1981). A non-disruptive technique for loading calcium buffers and indicators into cells. Nature 290:527-528.
Brooks S (2005). The discovery of aequorin and green fluorescent protein. Journal of Microscopy 217:1-2.
Shimomura O (2005). The discovery of aequorin and green fluorescent protein. Journal of Microscopy 217:3-15.
2008年10月4日星期六写
2008年10月5日星期天《科学网》公布
2008年10月6日星期一《科学时报》发表
2008年10月8日星期三,下村修、钱永健、Chalfie获得诺贝尔化学奖
15B 任尔东西南北风
人生不遇到困难,不太可能。
90年代美国生物学家普腊舍研究做得正当其时,但是他运气不好,这个世界会愚蠢地给他当头一棒,国内同行评议不给他研究经费,研究所内同行不欣赏他,使无法继续工作。以后一连串不幸,最后,一个做出了诺贝尔奖工作的科学家,以开公车勉强度日。
今年10月6日《美妙的生物荧光蛋白与好奇的生物化学家》一文介绍了下村修、约翰森、、钱永健、查尔菲、Inouye等人的研究工作。8日下村修、钱永健、查尔菲获化学奖。
写此文一方面是认为,在诺贝尔奖发奖时间附近,介绍科学和科学家是一种公众服务,也是促进科学的一种努力。另一方面,我比较担心下村修和普腊舍会被埋没和遗忘。结果出来,下村修终于在几十年后,得到了认可。一个不为名利的科学家,80高龄得到社会的推崇,是个美丽的故事。
但是,还有一个故事,比较悲惨:普腊舍。
普腊舍最早认识到绿色荧光蛋白可以用作生物示踪分子的重要性,他因此依据下村修获得蛋白质的序列,拿到了绿色荧光蛋白的基因。1992年,他将文章发表在《基因》杂志,一个读者不多的科学刊物。其后,因为他没有得到美国国立健康研究院的研究经费,不能继续做实验,而且不能在科学界待下去,他离开Woods Hole海洋生物学研究所,到空军基地一个美国农业部动植物服务处去工作。那是他1994年文章的地址。其他几个实验室问他要基因,他给了他们,他们表达了GFP,看到荧光。1994年钱永健和查尔菲的文章上,普腊舍也是共同作者。
这几年,有人在提名诺贝尔奖时,试图找到普腊舍,但是没有成功。
诺贝尔奖宣布后,美国记者找到了普腊舍。原来他不断失去几个工作,最后在偏僻的阿拉巴马州汉茨威尔市的车行,在车行和停车场之间开摆渡车。他家经济状况相当不好,入不敷出,存款几乎耗尽。
他对今年诺贝尔奖的反应是:钱和查尔菲做的工作,我没法做,我已经没有研究经费了。“他们如果来汉茨威尔,应该带我出去吃餐晚饭”。
发生在很多人预期比较好的美国,发生在很多人预期比其他很多行业更公平的科学界,发生在很多人比较尊重的诺贝尔奖。当然,人的评论,从来带有主观,美国的经费评审也好,诺贝尔奖委员会也好,都是人。诺贝尔化学奖评生物相关的奖出错频率比较高,也是事实。只是好些事情都发生在一个人身上,比较可惜。
感想:我们每个人对其他人应该公平,也应该为社会公平努力。但是自己心理也许有准备比较好,不要对社会公平预期太高,这样,也许失落可以少些。
也许,对有些事情,心理预期低,才能不怕外界出现问题,才能永远保持乐观。