深圳湾实验室张洋课题组发现膜蛋白超家族功能调控新机制
2024年11月4日 — 深圳湾实验室分子生理学研究所张洋研究员团队与杜克大学Yang Huanghe教授团队展开合作,在国际知名学术期刊《eLife》上发表题为“TMEM16 and OSCA/TMEM63 proteins share a conserved potential to permeate ions and phospholipids”的重要研究成果。该研究揭示了跨膜离子通道/磷脂翻转酶(TCS)蛋白超家族调控离子和磷脂跨膜运输的分子机制,为相关疾病治疗提供了新的策略思路。
TCS蛋白超家族在生命活动中扮演着关键角色。钙调离子通道/磷脂翻转酶的TMEM16家族和机械力/渗透压门控离子通道OSCA/TMEM63家族同属于TCS超家族,尽管这些蛋白的分子结构高度保守,但它们的功能表现出显著差异:TMEM16A-B为钙激活的氯离子通道,TMEM16C-K大多为钙激活的磷脂翻转酶,同时具有非选择性的离子通透性;OSCA/TMEM63是机械力/渗透压激活的阳离子通道。这些蛋白在多个重要生理过程中发挥作用,包括胚胎发育、神经元动作电位发放、凝血、细胞死亡、细胞吞噬、细胞融合以及病毒感染等过程。
对TCS蛋白超家族调控机制的研究,是理解他们生理、病理功能的关键。研究团队发现,TCS蛋白超家族在受到钙离子或机械力刺激时,会发生特征性的构象变化:TM4和TM6呈现贝壳状分离;这种构象变化直接调控着离子和磷脂的跨膜运输。研究发现,TMEM16A这种典型的钙激活氯离子通道,通过特定改造可获得新功能:在TMEM16A的TM4上引入特定的赖氨酸突变(如I546K和I547K),可以使TMEM16A获得自发的磷脂翻转酶活性。即使在无钙刺激条件下也能导致磷脂酰丝氨酸(PS)外翻。
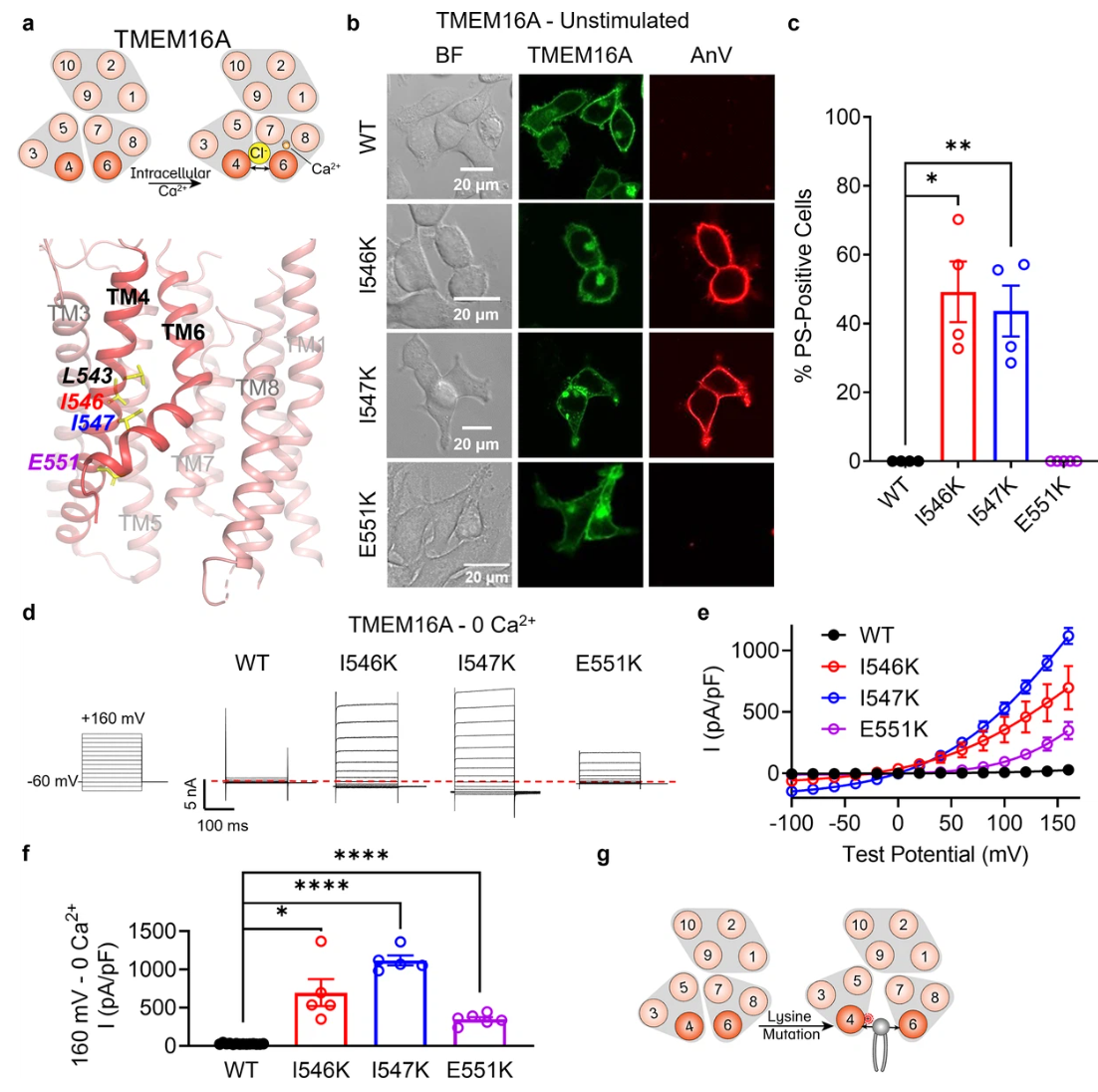
Figure 1 Lysine mutations along TM 4 enable TMEM16A channel and scramblase activities in the absence of calcium stimulation.
OSCA1.2是拟南芥中发现的一种机械力/渗透压激活的阳离子通道。通过在OSCA1.2的TM4上引入单个赖氨酸突变(如L438K),可以使OSCA1.2获得磷脂翻转酶活性,导致PS的外翻。此外,电生理实验结果显示,L438K突变的OSCA1.2表现出显著的离子通道活性增强,表明这种突变促进了OSCA1.2的通道开启,使其在没有额外刺激的情况下也能开放。分子动力学模拟结果显示,L438K突变显著增加了OSCA1.2通道区域的水合作用。这些结果均表明突变导致了跨膜区域4/6界面的开放。
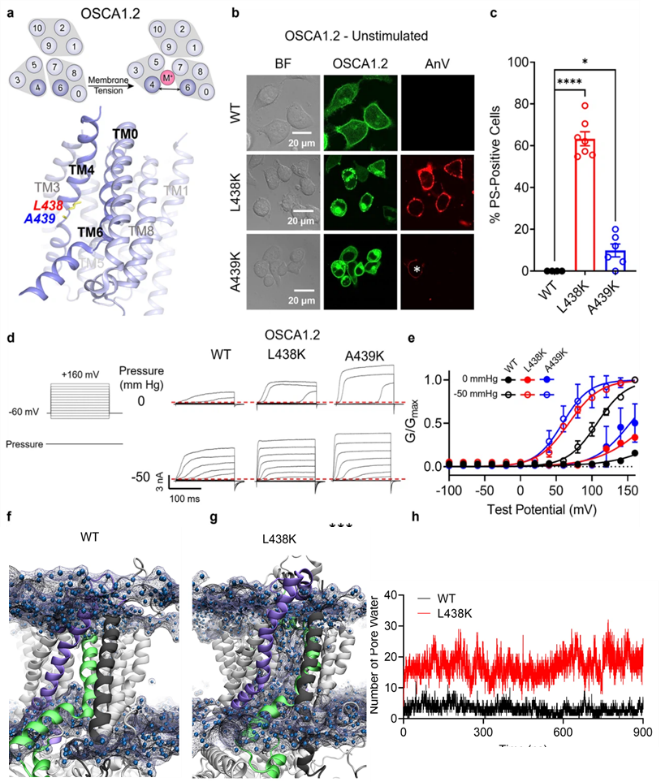
Figure 2 Lysine mutations along TM 4 enable OSCA1.2 channel and scramblase activities
作为OSCA在哺乳动物的同源蛋白,TMEM63也表现出相似的调控机制。通过在TMEM63A的TM4上引入单个赖氨酸突变,可以使机械力敏感的阳离子通道TMEM63A获得磷脂翻转酶活性,导致PS的外翻。
研究团队采用经典的生物物理学研究方法,阐明了TM4在TCS离子和磷脂跨膜运输中的关键调控作用,揭示了OSCA/TMEM63与TMEM16家族类似的功能潜力,为理解TCS超家族的蛋白质进化提供了新视角。同时,该研究提供了调控膜蛋白功能的新技术手段,为包括心血管疾病、神经退行性疾病、病毒感染在内的多种疾病的治疗开辟了新途径。这项研究不仅深化了我们对膜蛋白功能调控机制的理解,也为发展新的生物学研究方法以及针对性的疾病治疗策略提供了新的思路和方向。
原文链接:
https://doi.org/10.7554/eLife.96957.3
课题组招生招聘信息:
https://zhanglab.szbl.ac.cn/currentopenings/